چگونه میتوان ارگانیسمها را بر اساس ژنومشان از یکدیگر افتراق داد؟ یکی از ابزارهای مورداستفاده دانشمندان AFLP-PCR (amplified fragment length polymorphism polymerase chain reaction) میباشد. AFLP نمایانگر زیرمجموعهای از محصولات PCR است که از برش DNA ژنومی با آنزیم محدودکننده و اتصال (ligation) آنها به توالیهای adaptor حاصل شدهاند. سپس بخشی از قطعات حاصل توسط PCR با پرایمرهایی خاص، تکثیر میشوند.
مقالات مرتبط:
تصور کنید که دو نمونه DNA ژنومی از دو ارگانیسم ظاهرا مشابه که توالیشان مشخص نیست، جمعآوری شده و از شما خواسته شده است که تعیین کنید، آیا این دو از اعضای گونه یکسانی هستند یا نه؟ در این شرایط متخصصان ژنتیک میتوانند از تکنیک AFLP-PCR (amplified fragment length polymorphism polymerase chain reaction) استفاده کنند. این تکنیک حتی در مقادیر اندک DNA ژنومی نیز اثرانگشتهای DNAای که به میزان بالایی اختصاصی گونهای معین هستند، تهیه میکند. این روش نیازی به وجود هیچ گونه دانش قبلی از توالی موردبررسی ندارد.
انگشتنگاری DNA (DNA fingerprinting) فرایند تهیه مجموعهای از قطعات مشخص DNA از نمونه موردبررسی است. این قطعات سپس به عنوان منبعی از اطلاعات ژنوتیپی به کار برده میشوند. تکنیکهای فراوانی میتوانند به این منظور استفاده شوند. نوع تکنیک به کار گرفته شده بسته به نوع ارگانیسم مورد مطالعه و اطلاعات موردنیاز متفاوت است.
تمام تکنیکهای انگشتنگاری DNA با مارکرهای ژنتیکی مرتبط بوده و تفاوت تکنیکهای مختلف در تعداد و انواع مارکرهای موردبررسی است. به عنوان مثال برخی از روشها مارکرهای واقع در یک لوکوس را بررسی میکنند (single-locus markers)؛ درحالیکه سایر تکنیکها امکان بررسی همزمان لوکوسهای چندگانه را فراهم میکنند (multi-locus markers). برخی از روشها روی مارکرهای همغالب تمرکز داشته و اطلاعاتی در مورد هر دو الل واقع در یک لوکوس فراهم میکنند؛ در حالیکه تعدادی دیگر، با مارکرهای غالب که تنها وجود یا عدم وجود الل خواسته شده را گزارش میدهند، سروکار دارند و نمیتوانند اطلاعاتی همچون هوموزیگوس بودن فرد از لحاظ آن الل را فراهم کنند.
قدیمیترین متد مورداستفاده در انگشتنگاری DNA، آنالیز RFLP است که به طور گستردهای توسط محققان به منظور شناسایی ژنهای فراوانی که به بیماریهای تکژنی مندلی مانند بیماری هانتیگتون ارتباط دارند، به کار گرفته شده است. این تکنیک، بر اساس وجود یا عدم وجود جایگاه تشخیص آنزیم محدودکنندهای خاص و یا وجود جهشهای حذف یا اضافه در جایگاه تشخیص آنزیم، تفاوتهای موجود در طول قطعات DNA را تشخیص میدهد. با اینکه آنالیز RFLP نیازی به داشتن دانش قبلی در مورد توالی ژنوم ندارد، در صورت نبودشان بسیار وقتگیر و چالشبرانگیز میباشد. زمانی که دادههای مربوط به توالی در دسترس نیستند، پژوهشگر باید به صورت دستی ناحیهای از ژنوم موردمطالعه را کلون کند. این ناحبه باید به حدی بزرگ باشد که بتواند توسط آنزیم برش داده شود. انجام فرایند گفتهشده صرف منابع و زمان زیادی را میطلبد.
تکنیک انگشتنگاری DNA دوم، از نواحی میکروستلایت ژنوم استفاده میکند که حاوی تکرارهای توالی ساده یا SSRها (simple sequence repeats) میباشند. این توالیها تکرارهای چندگانه قطعات ۲ تا ۶ نوکلئوتیدی بوده و غالبا از ۲ تا ۳ نوکلئوتید تشکیل شدهاند (به عنوان مثال، CACACACA…). تعداد SSRهای موجود در نواحی میکروستلایت موردبررسی ژنوم غالبا در افراد مختلف متفاوت است. درنتیجه محققان میتوانند از روشهای PCR محوری که در آنها پرایمرها نواحی میکروستلایت را احاطه میکنند، به منظور تعیین طول SSRها استفاده کرد. اندازه محصولات PCR توسط الکتروفورز در ژل با رزلوشن بالا به دست میآید. این روش نیاز به داشتن اطلاعات قبلی در مورد ژنوم موردبررسی دارد تا بتوانیم پرایمرها را طراحی کنیم؛ اما میتواند امکان شناسایی اللهای چندگانه را در ناحیه میکروستلایت فراهم آورد.
تکنیکی دیگر از انگشتنگاری DNA که آنالیز RAPD نام دارد، از مجموعه پرایمرهای PCR که به منظور تکثیر تصادفی قطعات DNA پراکنده در کل طول ژنوم طراحی شدهاند، استفاده میکند. RAPD تکنیکی multilocus است که از شرایط low-stringency PCR بهره گرفته و باعث تکثیر تصادفی نواحی ژنومی میگردد. این روش میتواند در شرایط نبود اطلاعات قبلی در مورد توالی انجام شود، اما شرایط low-stringency میتوانند گاها چالشهایی را در زمینه تفسیر نتایج یا قابلیت بازتولید آنها ایجاد کند.
امروزه محققان بیشتر به استفاده از AFLP در انگشتنگاری DNA گرایش دارند. AFLP-PCR دارای مراحل مشترک بسیاری با RFLP، SSR و RAPD است؛ از جمله تجزیه DNA با آنزیم محدودکننده، PCR و تفکیک قطعات DNA با الکتروفورز. البته این متد دارای مراحل دیگری است که امکان بررسی کل ژنوم با رزلوشن بالا را فراهم کرده و اطلاعاتی با اختصاصیت و قابلیت بازتولید بالا را به دست میدهد. AFLP تنها در مورد مارکرهای ژنتیکی غالب استفاده میشود و نیازی به داشتن اطلاعات قبلی از توالی ژنوم موردبررسی ندارد.
فرایند AFLP-PCR
AFLP-PCR برای نخستین بار در سال ۱۹۹۵ و توسط Pieter Vos و همکارانش توصیف شد. این تکنیک دارای ۵ مرحله اساسی است:
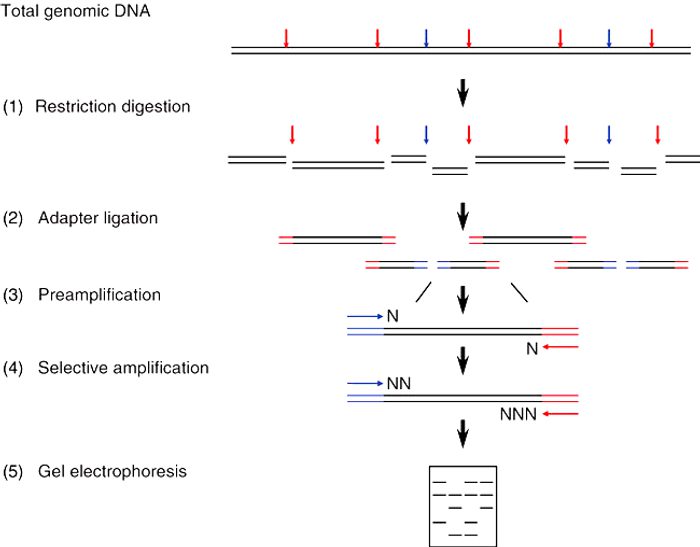
مرحله ۱: فراهم کردن توالی الگوی AFLP
آنالیز AFLP با نمونه DNA ژنومی استخراج شده و خالصسازی شده از ارگانیسم مورد مطالعه آغاز میشود. تکنیکهای استخراج DNA ژنومی به طور گستردهای موجود بوده و به آسانی قابل تطبیق با ارگانیسمهای مختلف میباشند. پس از استخراج، DNA ژنومی با یک جفت آنزیم محدودکننده (یا بیشتر) که غالبا Msel و EcoRI میباشند، تجزیه می شود. آنزیمهای محدودکننده آنریمهایی هستند که توالیهای پالیندرومیک خاصی را که معمولا طولی در حدود ۴، ۶ و یا ۸ جفتباز دارند، شناسایی کرده و یک جفت nick را در محل ایجاد میکنند (یک عدد در هر رشته). این امر منجر به تشکیل برش دورشتهای کاملی شده و معمولا انتهاهای چسبنده را ایجاد میکند. مدت زمان این مرحله باید به حدی باشد که تقریبا تمام جایگاههای تشخیص بتوانند برش داده شوند.
Msel توالی ۵’-TTAA-3’ را شناسایی کرده و ناحیه پس از ۵’-T را برش میدهد. این در حالی است که EcoRI توالی ۵’-GAATTC-3’ را شناسایی و ناحیه پس از ۵’-G را برش میدهد. زمان انکوباسیون آنزیمها با DNA ژنومی به حدی طولانی است که امکان هضم کامل DNA را فراهم آورد. Msel و EcoRI قطعات DNA با overhangهای ۵’ (به ترتیب ۵’-TA-3’ و ۵’-AATT-3’) که متمایز از همدیگر بوده و غیرمکمل هستند را ایجاد میکند.
نتیجه این فرایندها، تبدیل DNA ژنومی کامل و دستنخورده به تعداد بسیار فراوانی ازقطعات کوچکتر است. زیرگونههای مختلف از هر ارگانیسم قطعا دارای تفاوتهایی هر چند کوچک مانند حذفها، اضافهها و جایگزینیهای نوکلئوتیدی خواهند بود که منجر به تغییر اندازه تعدادی از قطعات نهایی خواهد شد و یا جایگاه تشخیص آنزیم را تغییر خواهند داد.
مرحله ۲: واکنش ligation با قطعات حاصل از آنزیم محدودکننده و adaptorها
پژوهشگران برای اینکه بتوانند از قطعات DNA ژنومی حاصلشده از تجزیه آنزیمی Msel و EcoRI استفاده کنند، نیازمند متدی بودند که به آنها امکان تولید نوع منحصربهفردی از اثرانگشت DNA را میداد. آنان درنتیجه Msel adaptor و EcoRI adaptor را ایجاد کردند. هر کدام از این adaptorها، مولکولهای DNA کوتاه دورشتهای با ۵′ overhang ای هستند که مکمل ۵′ overhang تشکیلشده توسط MseI (5′-TA-3′) و EcoRI (5′-AATT-3′) است. Msel adaptor به جای اینکه بعد از ۵′-TA-3′ overhang حاوی ۳’-A باشد، دارای ۳’-C است که پس از اتصال به جایگاه تشخیص Msel، آن را تخریب میکند. به طور مشابهی، EcoRI adaptor به جای اینکه بعد از ۵′-AATT-3′ overhang دارای ۳’-C باشد، حاوی ۳’-G است که پس از اتصال به جایگاه تشخیص Eco-RI آن را تخریب میکند. Msel adaptor و EcoRI adaptor هر کدام حاوی توالی DNA اختصاصی خود هستند که معمولا طولی در حدود ۱۹ تا ۲۲ جفتباز داشته و در بالای ۵′ overhang مربوط به خود قرار دارد. واکنش ligation ذکرشده، متشکل از انکوباسیون قطعات تجزیهشده DNA ژنومی به منظور کنارهمقرارگرفتن آنها تحت تاثیر دو adaptor و DNA لیگاز است. این آنزیم adaptorها را با پیوند کووالانسی به انتهای ۵’ مربوط به خود متصل میکند. آنزیمهای محدودکننده Msel و EcoRI نیز میتوانند به این واکنش اضافه شوند و جلوی اتصال مجدد قطعات ژنومی EcoRI-EcoRI و MseI-MseI را بگیرند. این آنزیمها توانایی شناسایی و هضم قطعات adaptor-genomic DNA را ندارند.
مرحله ۳: تکثیر انتخابی توسط PCR
پس از اتصال قطعات DNA ژنومی به adaptorهای مربوط به خود، محققان با مجموعهای از قطعات DNA ژنومی روبرو میشوند که محتوی توالیهای مرتبط با Msel adaptor، جایگاه تشخیص تخریبشده MseI، قطعهای از DNA ژنومی، جایگاه تشخیص تخریبشده EcoRI و توالی مرتبط با EcoRI adaptor میباشند. درنتیجه، هر قطعه DNA ژنومی منحصربهفرد میان Msel adaptor و EcoRI adaptor و توالیهای منحصربهفرد مربوط به آن ها احاطه شده است.
با اینکه هر کدام از انتهاهای متصل به EcoRI adaptor و Msel adaptor در قطعات DNA یکسان هستند، توالیهایی از DNA ژنومی که بلافاصله بعد از جایگاههای اصلی Msel و EcoRI شروع میشوند، متفاوت میباشند. در صورتیکه محققان واکنشهای PCR را با بهکارگیری پرایمرهایی که منطبق بر توالیهای Msel adaptor و EcoRI adaptor هستند، انجام دهند، با مجموعهای غیرقابل تفسیر از قطعات DNA روبهرو خواهند شد. درنتیجه به منظور تکثیر انتخابی تعداد کمتری از قطعات، محققان از مجموعه پرایمرهایی استفاده میکنند که مکمل توالیهای Msel adaptor و EcoRI adaptor بوده، از انتهای ۵’ آنها شروع شده و دارای ۳ نوکلئوتید منحصربهفردی هستند که پس از انتهاهای جایگاه تشخیص EcoRI و Msel میآید. افرودن این تعداد اندک از جفتبازها به انتهای هر پرایمر که نوکلئوتیدهای انتخابی نیز نامیده میشوند، امکان تکثیر زیرمجموعهای از قطعات DNA ژنومی را فراهم میکند. هر چقدر ژنوم موردبررسی پیچیدهتر باشد، محققان نوکلئوتیدهای انتخابی بیشتری را به پرایمرها میافزایند. برخی از ژنومهای سادهتر ممکن است اصلا به نوکلئوتیدهای انتخابی نیازی نداشته باشند.
با افزایش تعداد نوکلئوتیدهایی که به انتهای ۳’ هر پرایمر افزوده میشوند، selectivity پرایمر نیز افزایش مییابد. تعداد قطعات DNA ژنومی که با پرایمری حاوی یک باز اختصاصی در انتهای ۳’ تکثیر میشوند، در مقایسه با پرایمری که حاوی ۳ بازاست، بیشتر است. طراحی پرایمر نیازی به وجود دانش قبلی از ژنوم مورد مطالعه ندارد. محققان تنها واکنشهای PCR را با استفاده از مجموعه متنوعی از پرایمرها راهاندازی میکنند که هر کدام حاوی یک پرایمر مرتبط با Msel و یک پرایمر مرتبط با EcoRI میباشد. واکنشهای AFLP-PCR تحت شرایطی stringent انجام میگیرند. درنتیجه تنها قطعاتی اجازه تکثیر مییابند که کاملا مکمل انتهای ۳’ پرایمر هستند. شرایط stringent در PCR منجر به نتایجی با قابلیت بازتولید بالا میشود که به سادگی قابل مقایسه با سایر نمونهها میباشند. آنزیم مورداستفاده در تکثیر باید nonproofreading باشد تا از حفظ اختصاصیت انتهای ۳’ پرایمر اطمینان حاصل کنیم. از جمله این آنزیمها Taq DNA پلیمراز است.

مرحله ۴: تفکیک قطعات DNA تکثیرشده توسط الکتروفورز
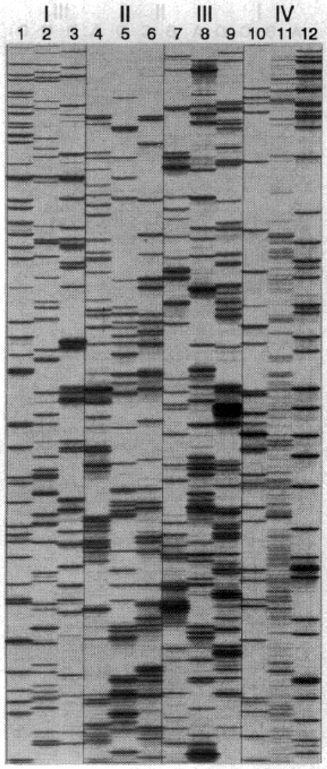
واکنشهای PCRای که حین مرحله سوم فرایند AFLP-PCR انجام میگیرند، به طور همزمان انواع فراوانی از قطعات DNA اندازه را تکثیر خواهند کرد که اندازه آنها به قطعات DNA ژنومی Msel- EcoRI اولیه که به Msel و EcoRI Adaptorها متصل شدهاند، بستگی دارد. برای شناسایی اثرانگشت DNA مشتق از AFLP-PCR، محققان باید قادر باشند که مجموعه قطعات DNA تولیدشده در واکنش PCR گفتهشده را شناسایی کنند. درنتیجه در بسیاری از موارد، یکی از دو پرایمر، با مواد رادیواکتیو یا فلورسنت لیبل شده (معمولا پرایمر EcoRI) و این امر منجر به تولید محصول PCR لیبلشدهای میشود که میتواند به آسانی شناسایی گردد. محققان همچنین میتوانند از الکتروفورز high-resolution به منظور تفکیک قطعات DNA بر اساس اندازه و بار کلی منفی استفاده میکنند. با قرارگیری در میدان الکتریکی، قطعات بزرگتر، آهستهتر و قطعات کوچکتر، سریعتر حرکت میکنند. تصویر ۳ نشاندهنده اطلاعات حاصل از AFLP است که از گیاه Arabidopsis، گوجهفرنگی، ذرت و انسان به دست آمدهاند. DNA ژنومی این نمونهها توسط EcoRI و Msel تجزیه شده و تکثیر هر کدام از آنها توسط سه مجموعه پرایمری مختلف انجام گرفته است. قطعات DNA حاصل طولی در حدود ۴۵ تا ۵۰۰ نوکلئوتید دارند. همانطور که در تصویر نشان داده شده است، بهترین نتایج زمانی حاصل شدهاند که پرایمرهای AFLP با سه نکلئوتید انتخابی به کار گرفته میشوند.
مرحله ۵: آنالیز
به دنبال AFLP-PCR، محققان الگوی نوارهای DNA حاصل را بررسی میکنند تا اثرانگشتی را که مربوط به نمونه موردمطالعه است، تعیین کنند. بسته به میزان پیچیدگی الگوی نوارها، محققان میتوانند به صورت دستی اندازه نوارها را به دست آورده و یا از روشهای اتوماتیک استفاده کنند. از آنجایی که AFLP-PCR تنها قادر به تشخیص مارکرهای ژنتیکی غالب است، نمیتواند هوموزیگوت بودن فرد از لحاظ مارکر موردبررسی را تعیین کند. البته این تکنیک امکان تکثیر همزمان قطعات DNA چندگانه (غالبا بین ۵۰ تا ۱۰۰ قطعه در یک واکنش PCR) را با اختصاصیت و قابلیت بازتولید بالا و در غیاب هر گونه اطلاعات قبلی از توالی موردبررسی، فراهم میکند.
AFLP و RFLP
در واقع آنالیز AFLP روشی موثرتر برای انجام کاری است که آنالیز RFLP برای انجام آن اختراع شده است. همان طور که گفته شد، AFLPها پلیمورفیسمهایی در DNA هستند که امکان تمایز ژنوم یک ارگانیسم را از دیگری فراهم میکنند. در مورد انسانها، مارکرهای AFLP، تکنیک انتخابی در تستهای ابوت و آنالیزهای جنایی میباشند و توسط PCR و الکتروفورز تعیین میگردند. اندازه توالی، نوع الل را نشان خواهد داد.
پیش از اختراع تکنیک آنالیز AFLP، تعیین هویت DNA توسط آنالیز RFLP انجام میشد. آنالیز RFLP به شکلی کاملا متفاوت انجام میگیرد. طی این فرایند DNA ژنومی تحت تاثیر مجموعهای از آنزیمها محدودکنندهی معین تجزیه شده و به قطعات کوتاهتری تقسیم میشود. این هضم منجر به تولید مجموعهای از توالیهای DNA با طولهای متفاوت میگردد. الکتروفورز میتاوند طول این قطعات را معین کند.
مجموعهای از قطعات DNA تولیدی از یک ژنوم در اثر آنالیز RFLP دارای ترکیبی معین از قطعات با طولهای متفاوت خواهد بود. الگوی حاصله، اثر انگشتی از ژنوم است. ژنوم افراد مختلف، بسته به توالی و تعداد و موقعیت جایگاههای تشخیص، که از فردی به فرد دیگر متفاوت است، دارای مجموعهای متفاوت از قطعات DNA خواهد بود.
RFLPها در تعیین ابوت بسیار دقیق و موثر عمل میکنند؛ با این حال، به اندازه AFLPها ایدهآل نمیباشند. علت آن است که آنالیز RFLP، ۱) نیازمند مقادیر فراوانی از DNA بوده، و ۲) نیازمند نمونهای باکیفیت از DNA دست نخورده و تجزیه نشده میباشد. چنین نیازمندیهایی به نمونه DNA با integrity بالا، آنالیز RFLP را نسبت به AFLP، برای استفاده در موارد جنایی ناکارآمد میکند. در صحنههای جرم، غالبا DNA به دست آمده از قطرات خون و یا تعداد ناچیزی از فولیکولهای مو، در مقادیر اندک بوده و نسبتا تجریهشده میباشد.
چگونه از اطلاعات AFLP-PCR استفاده کنیم؟
امروزه، میتوان با اطلاعات حاصله از AFLP پاسخ انواع گستردهای از سوالات را داد. این تکنیک، خصوصا در مورد سوالات مرتبط با ارگانیسمهایی که توالی ژنوم آنها هنوز به خوبی شناخته نشده است، از جمله بسیاری از گیاهان، قارچها و باکتریها، بسیار مفید واقع میشود. AFLP میتواند در تعیین اینکه آیا دو ارگانیسم اعضای یک گونه هستند یا نه، بسیار کمککننده است. به علاوه، این تکنیک میتواند به منظور ارزیابی واریانتهای ژنتیکی در داخل یک گونه و یا بین گونههای نزدیک به کار رود. متخصصان ژنتیک جمعیت از روش AFLP به منظور تعیین واریانتهای ژنتیکی موجود بین جمعیتهای مختلف استفاده میکنند. این متد قطعا در بهبود طبقهبندیهای تاکسونومیک ارگانیسمها بر پایه مارکرهای ژنتیکی مرتبط با AFLP، کمکهای شایانی به محققان کرده است.
از این روش در مقایسه نمونههایی استفاده میشود که صفات فنوتیپی خاصی را نمایش میدهند و نوارهایی که در یک فنوتیپ ظاهر میشوند اما در دیگری نه، ممکن است مارکرهایی را نمایش دهند که به مارکر فنوتیپی خاصی مرتبط هستند. استفاده از مارکرهای AFLP ابزاری قدرتمند را به منظور اعمال استراتژیهای دورگهزایی در گیاهان و جانوران فراهم میآورد.
AFLP همچنین میتواند در مورد ژنومهایی که پیشتر توالییابی شدهاند، به کار رود. به عنوان مثال، AFLP در مورد نمونههای DNA انسانی و به منظور بررسیهای جنایی و تستهای ابوت به کار گرفته شود. البته شناسایی تنها یک مارکر AFLP در تعیین هویت افراد کافی نخواهد بود. به عنوان مثال، دو مظنون جرم ممکن است از لحاظ آن مارکر دارای اللهای یکسانی باشند. در نتیجه شواهد ژنتیکی معمولا به مجموعهای از AFLPها اطلاق میگردد و به پروفایل AFLP موسوم است. هر چه تعداد AFLPهای بررسیشده در قالب پروفایل ژنتیکی فرد بیشتر باشد، اثر انگشت ژنتیکی حاصله اختصاصیتر خواهد بود. در نتیجه با افزایش تعداد AFLPهای یک پروفایل، احتمال وجود پروفایلی مشابه یا یکسان میان دو فرد غیرمرتبط کاهش خواهد یافت.
در بیمارستانها از AFLP به منظور ردیابی بحرانهای مربوط به پاتوژنها، هم در حالت پراکندگی یکی از سویهها و هم در حالت شیوع سویههای متفاوت، استفاده میشود. در این نوع از آنالیز، ارگانیسم پاتوژنیک از بیماران آلوده جدا شده و تحت آنالیز AFLP قرار میگیرد. با مقایسه دادههای AFLP گردآوری شده از بیماران مختلف، محققان خواهند توانست به آسانی ریشه بحران پاتوژنیک و تکگونهای و یا چندگونهای بودن آن را تعیین کنند.
علاوه بر کاربرد گسترده AFLP-PCR در انگشتنگاری DNA، روشهای مبتنی بر AFLP در تهیه اثرانگشتهای بیان ژن نیز به کار میروند. اثر انگشتهای بیان ژن AFLP با استفاده از cDNAها (به جای DNA ژنومی) به عنوان الگوی PCR انجام میگیرد. با استفاده از این روش محققان قادر هستند بیان ژن را در لوکوسهای چندگانه بسنجند و از آن به عنوان وسیلهای برای مقایسه میان دو فرد یا جمعیت مختلف بهره گیرند. پیشبینی میشود که در سالهای پیش رو، با افزایش روزافزون سوالات پیچیده ژنتیکی محققان، تکنیک AFLP نیز تکامل پیدا کند.
