محققان موفق به ابداع روشی جهت خاموشسازی ژن در سلولهای ایمنی T شدهاند.
در بدن ما، اطلاعات خام مورد نیاز برای تولید پروتئینها به صورت سلسله کدهایی در ژنوم ذخیرهسازی شده است. برای بیان هر نوع پروتئین، ابتدا باید ژن مربوط به آن رونویسی شده و mRNA (مولکول پیامرسان) حاصل نیز ترجمه شود. با این حال برخی موارد از قبیل اتصال یک الیگونوکلئوتید آنتیسنس (Antisense Oligonucleotide – اولیگونوکلئوتید به قطعات کوتاه RNA و یا DNA اطلاق میشود. آنتیسنس نیز به معنی “مکمل” است؛ بدین ترتیب که توالی اولیگونوکلئوتید مذکور مکمل یک رشتۀ نوکلئیک اسیدی دیگر است) به mRNA باعث ایجاد اختلال در فرآیند ترجمه میشود. در دست گیری این مکانیسم تداخلی در ترجمۀ mRNA (که تحت عنوان RNA interference یا RNAi شناخته میشود) یکی از زمینههای تحقیقاتی گسترده در عرصه ژنتیک است؛ چرا که میتواند به کنترل بیان ژن به شکل مصنوعی کمک نماید.
هماکنون تعدادی از روشهای خاموشسازی ژن از قبیل siRNA و CRISPR-Cas9 در دسترس است؛ با این حال هیچکدام از این روشها جهت خاموشسازی ژن در لنفوسیتهای T به اندازۀ کافی کارآمد نیست. ولی گویا پژوهشگران دانشگاه فنی نانیانگ سنگاپور (Nanyang Technological University) موفق شدهاند روشی کارآمد را توسعه دهند.
دکتر نوین ورما (Navin Verma) یکی از محققان “انستیتو تحقیقات چشمی سنگاپور” (Singapore Eye Research Institute) و همچنین آزمایشگاه سلولی-مولکولی دانشگاه نانیانگ، در این باره میگوید:
اصلیترین چالش جهت توسعۀ تکنیک RNAi، پایداری سلول و همچنین اولیگونوکلئوتیدهای مهارکننده در بدن است. چالش بزرگتر خاموشسازی یک ژن خاص بدون ایجاد هرگونه عوارض جانبی در بیان ژنهای دیگر است. GapmeR نسل جدیدی از مولکولهای خاموشکنندۀ ژن محسوب میشود؛ روش ساخت آن هم اضافه نمودن مولکولهای نوکلئیک اسیدی قفلشده (Locked Nucleic Acid) به دو انتهای یک قطعه DNA آنتیسنس به طول ۵ الی ۱۰ نوکلئوتید است. این اصلاحات ساختاری موجب افزایش میل اتصال (Affinity) هدف، منحصربهفرد شدن توالی، پایداری زیستی و خصوصیات فارماکوکنیتیک (Pharmacokinetic) مطلوب در GapmeR میشود.
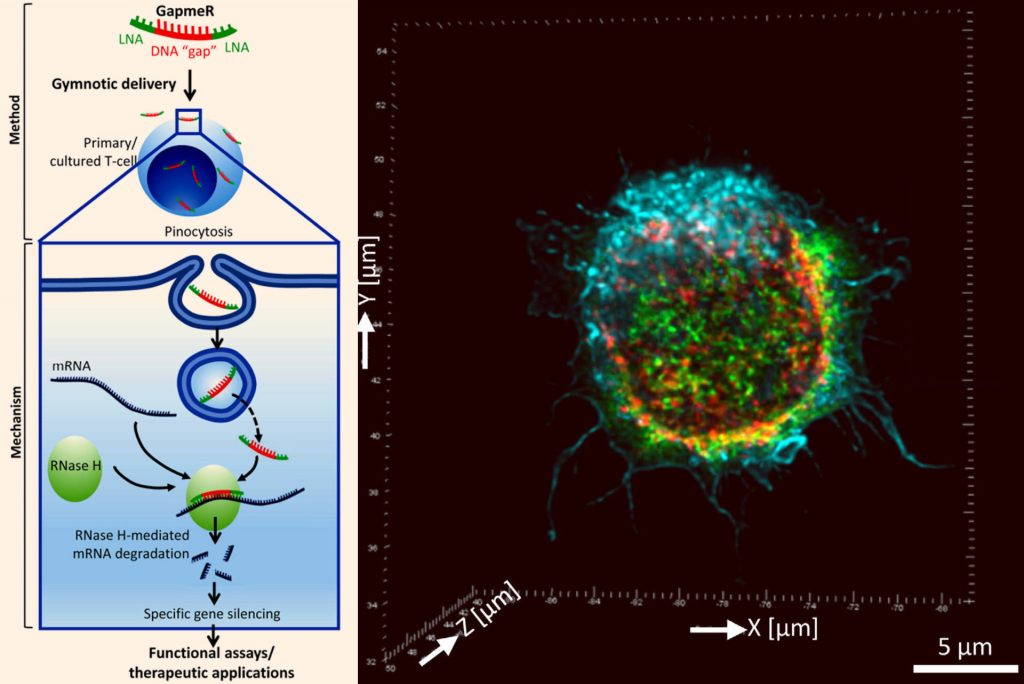
راست تصویر میکروسکوپی فراتفکیکپذیر (Super-Resolution) از مولکول GapmeR به همراه پروتئین SNX5 در سلول T.
در این مطالعه، دکتر ورما و همکارانش تعدادی مولکول GapmeR اختصاصی ساختند که میتوانست گروهی از ژنهای لنفوسیتهای T را کنترل کند. گروه همچنین در طی این مطالعه موفق به کشف دو پروتئین جدید به نامهای CGNAP/AKAP450 و استاتمین (Stathmin) شد که نقشی حیاتی در تحرک لنفوسیت T بازی میکنند.
پروفسور درموت کلهر (Dermot Kelleher) از دانشگاه بریتیش کلمبیا (British Columbia) توضیح میدهد:
این مطالعه علاوه بر تشخیص و کنترل پروتئینهای ضروری در کارکرد سلولهای T، روش بدیعی جهت خاموشسازی یک ژن منفرد و یا مجموعهای از ژنهای دلخواه در گویچههای سفید خون، فراهم آورده است. اگر ما بتوانیم اصلاحات کوچکی (Fine-Tuning) در سلولهای ایمنی بافتهای مجزا ایجاد کنیم، خواهیم توانست از طریق این تکنیک، بیماریهای خودایمنی را به شکل مؤثرتری نسبت به انواع داروها – با عوارض جانبی جدی مانند لوکوانسفالوپاتی چندکانونی (Multi-focal Leukoencephalopathy) در مغز – مدیریت کنیم.
