ژنها از ملکول DNA ساخته شدهاند. انتقال ژن به معنی وارد کردن DNA بیگانه به سلولهای میزبان است. انتقال ژن در طبیعت یکی از مکانیسمها تکامل است و از طریق انتقال افقی ژنها از یک ارگانیسم به ارگانیسم دیگر رخ میدهد. یک انتقال موفق ژن نیازمند راهی برای وارد کردن DNA به سلولها و وارد عمل کردن آن است. به ابزار انتقالدهندهی DNA به سلول، وکتور گفته میشود.
وکتوری وجود ندارد که بتوان برای درمان همهی بیماریها ازآن استفاده کرد. همانند هر نوع درمان پزشکی، وکتور ژندرمانی نیز باید برای ویژگیهای خاص هر بیماری اختصاصی باشد. یکی از چالشهای ژندرمانی انتخاب مناسبترین وکتور برای درمان بیماری است. یک وکتور مناسب باید ویژگیهای زیر را داشته باشد:
- بتواند به درستی سلولهای مورد نظر را هدفگیری کند؛ اگر قصد انتقال ژنی را به سلولهای کبد داشته باشیم این ژنها نباید سر از انگشت شست پا درآورند!
- ژن را درون سلولها ادغام کند؛ ژن منتقل شده باید با ژنوم سلول میزبان یکی شده و یا بخشی از آن شود و یا اینکه ژن بتواند به هر طریقی درون هسته دوام آورده و پاکسازی نشود.
- ژن را فعال کند؛ ژن باید وارد هسته سلولها شده و فعال شود، بدین معنی که ژن باید بیان شده و به محصولات پروتئینی ترجمه شود. انتقال ژن زمانی موفق است که این پروتئینها به درستی عمل کنند.
- عوارض جانبی خطرناک نداشته باشد؛ هر ماده بیولوژیکی بیگانهای که وارد بدن میشود ممکن است سمی باشد و یا پاسخ ایمنی بدن را برانگیزد.
وکتورهای مورد استفاده برای انتقال ژن را میتوان در دوسته تقسیم کرد: وکتورهای ویروسی و وکتورهای غیرویروسی.
وکتورهای ویروسی
طبیعت دانشمند خبرهای است، در طول بیش از ۳ بیلیون سال روش فوقالعاده کارآمدی را برای انتقال ژنهای بیگانه به سلولها ایجاد کرده است: ویروسها.
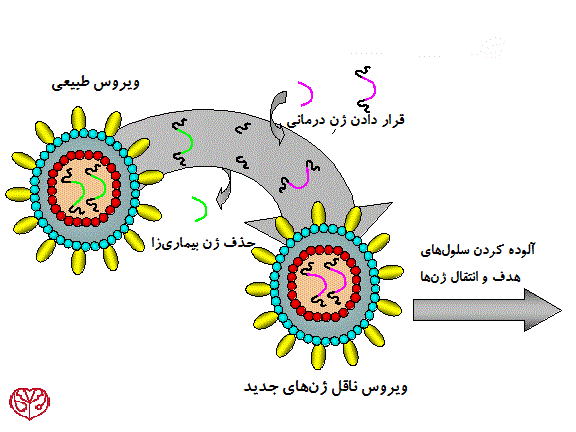
زمانیکه کلمهی ویروس را میشنویم معمولاً به بیماریهایی مانند سرماخوردگی، آنفولانز و یا ایدز فکر میکنیم؛ اما درواقع دانشمندان توانستهاند از ویروسها برای انتقال DNA به سلولها و ژن درمانی استفاده کنند. با تغییر ژنوم ویروس و غیربیماریزا کردن آن، میتوان یک ناقل بسیار مناسب برای ژندرمانی به دست آورد.
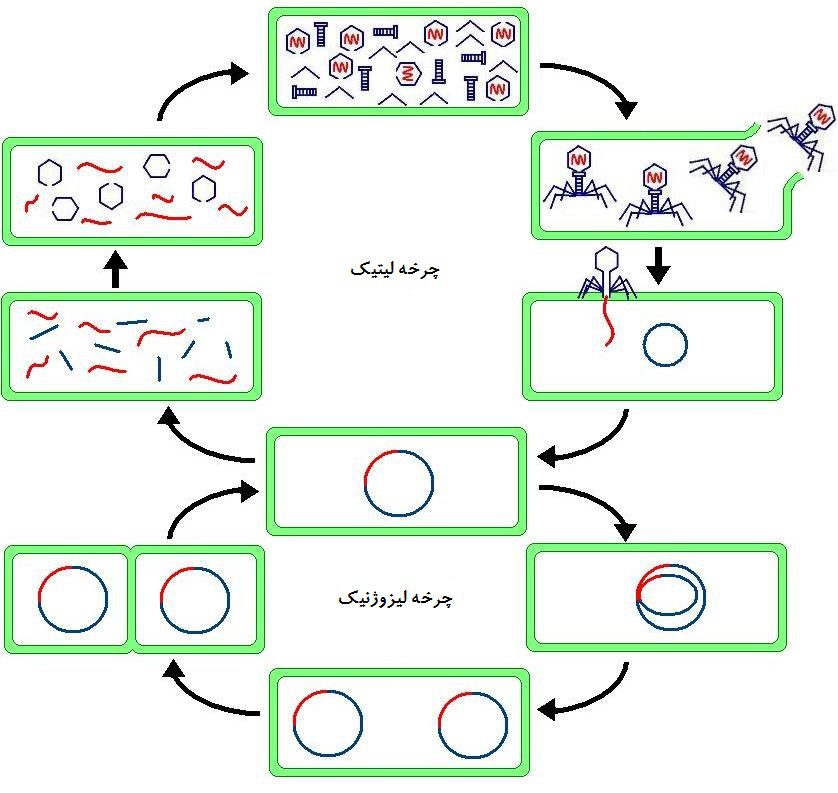
همهی ویروسها به عنوان بخشی از چرخهی همانندسازی خود، به سلولهای میزبان متصل شده و مادهی ژنتیکشان را به سلول میزبان تحمیل میکنند. این ماده ژنتیکی شامل اطلاعات پایهای برای ساخت کپیهای بیشتری از ویروس و هک کردن اعمال عادی سلول در جهت بر طرف کردن نیازهای ویروس است. برخی از انواع ویروسها فقط ژنوم خود را به سیتوپلاسم سلول میزبان تزریق میکنند و خود وارد سلول نمیشوند. سایر ویروسها به غشاء سلول میزبان نفوذ کرده و به شکل ملکولهای پروتئینی وارد سلول میشوند.
دو نوع اصلی عفونت ویروسی وجود دارد: لیتیک و لیزوژنیک. ویروسهای چرخه لیتیک بلافاصله پس از وارد کردن DNA خود همانندسازی را شروع کرده و ویروسهای بیشتری تولید میکنند که موجب ترکیدن سلول میزبان شده و عفونت را در سلولهای اطراف پخش میکند. ویروسهای لیزوژنیک DNA خود را یا DNA سلول میزبان ادغام کرده و ممکن است تا زمان دریافت محرک مناسب، سالها درون سلول میزبان زندگی کنند، محرک DNA را از ژنوم سلول میزبان آزاد کرده و سلول میزبان را وادار به ساخت ویروسهای بیشتر میکند.
رتروویروسها
ماده ژنتیکی رتروویروسها از نوع RNA میباشد درحالیکه ماده ژنتیکی میزبان از نوع DNA است؛ بنابراین زمانیکه یک رتروویروس سلول میزبان را آلوده میکند به همراه RNA خود آنزیمهای ترانس کریپتاز معکوس و اینتگراز را نیز وارد سلول میکند. به کمک آنزیم ترانس کریپتاز معکوس یک کپی DNA از ملکول RNA رتروویروس ساخته میشود تا ماده ژنتیکی رتروویروس بتواند با ماده ژنتیکی میزبان ادغام شود. این DNA کپی باید وارد ملکولها بزرگ DNA سلول میزبان (کروموزومها) شود، این فرآیند به کمک آنزیم اینتگراز انجام میگیرد.
با ادغام ماده ژنتیکی ویروس گفته میشود که سلول میزبان تغییر یافته و حاوی ژنهای جدید است. اگر سلول میزبان تقسیم شود، همهی سلولهای حاصل از آن نیز حاوی این ژنهای جدید خواهند بود.
یکی از مشکلات استفاده از رتروویروسها در ژن درمانی این است که آنزیم اینتگراز ماده ژنتیکی ویروس را خودسرانه به هر موقعیتی از ژنوم میزبان که بخواهد وارد میکند. بنابراین ژن جدید به طور تصادفی وارد ژنوم میزبان شده و ممکن است توالی یک ژن مهم را قطع کند (جهش درج). اگر ژن قطع شده یکی از ژنهای تنظیمکننده تقسیم سلولی باشد تقسیمات سلولی غیرقابل کنترلی رخ خواهد داد. برای حل این مشکل از آنزیم زینک فینگر نوکلئاز و یا برخی توالیهایی مانند نواحی کنترل بتاگلوبین برای هدایت محل ادغام به ناحیه مشخص کروموزوم، استفاده میشود.
تا به امروز کارآزماییهای ژن درمانی که از وکتورهای رتروویروسی برای درمان نقص ایمنی شدید توام (SCID) استفاده کردهاند، جزو موفقترین کارآزماییها بودهاند. اما برخی بیماران با وجود درمان SCID، به دلیل جهشهای ناشی از وکتورهای رتروویروسی به سرطان خون مبتلا شدند.
آدنوویروسها
ماده ژنتیکی آدنوویروسها به شکل DNA دو رشتهای میباشد. آدنوویروسها در انسان موجب عفونتهای تنفسی، رودهای و عفونتهای مربوط به چشم میشوند (به خصوص در سرماخوردگی). ماده ژنتیکی آدنوویروسها با ماده ژنتیکی میزبان ترکیب نمیشود بلکه به صورت آزاد درون هسته سلول باقی میماند، دستورالعملهای این DNA اضافی همانند سایر ژنهای سلول میزبان رونویسی میشود. اما زمانی که سلول تقسیم شود این DNA اضافی به هیچ یک از سلولهای حاصل از آن منتقل نخواهد شد؛ درنتیجه درمانهایی که توسط آدنوویروسها صورت میگیرند در یک جمعیت سلولی درحال رشد نیاز به تکرار مجدد خواهند داشت. وکتورهای آدنوویروسی بیشتر برای درمان سرطان مورد استفاده قرار میگیرند. اولین ژن درمانی که برای درمان سرطان مجوز دریافت کرد Gendicine بود، Gendicine آدنوویروسی است که در سال ۲۰۰۳ توسط سازمان غذا و داروی چین به عنوان درمانی برای سرطان سر و گردن پذیرفته شد.
در سال ۱۹۹۹ پس از مرگ یکی از شرکتکنندگان کارآزمایی ژن درمانی(Jesse Gelsinger)، نگرانیهایی نسبت به ایمنی استفاده آدنوویروسها بوجود آمد؛ بنابراین در استفاده از وکتورهای آدنوویروسی تنها ویروسهایی به کار گرفته میشوند که به طور ژنتیکی کاملاً غیرفعال شده باشند.
پوشش پروتئینی کاذب وکتورهای ویروسی
وکتورهایی ویروسی که توضیح داده شد به طور طبیعی میزبانهایی دارند که قادرند به طور موثر آنها را آلوده میکند. رتروویروسها دارای دامنه محدودی از سلولهای میزبان طبیعی هستند و با اینکه آدنوویروسها و ویرسهای AAV۱ قادرند گستره وسیعی از سلولها را آلوده کنند، اما برخی سلولها در مقابل عفونتهای ناشی از این ویروسها مقاوم هستند. اتصال و وارد شدن به درون یک سلول مستعد توسط پوشش پروتئینی سطح ویروس میانجیگری میشود. رتروویروسها و ویروسهای AAV تنها یک پوشش پروتئینی دارند که غشاء آنها را میپوشاند اما آدنوویروسها علاوه بر این پوشش پروتئینی دارای فیبرهایی هستند که از سطح سلول به بیرون گسترش مییابد. پوشش پروتئینی هر ویروس به ملکولهای سطحی سلول مانند هپارین سولفات متصل میشود، این اتصال به همراه گیرندههایی پروتئینی خاص موجب ساکن شدن ویروس در سطح سلول میشود؛ بدین ترتیب زمینه برای تغییرات ساختاری که برای ورود ویروس به درون سلول لازم است ایجاد میشود. بنابراین ورود به یک سلول میزبان نیازمند تعامل موثر میان پروتئینهای سطحی ویروس و پروتئینهای سطحی سلول میزبان است.
برای انجام ژندرمانی ممکن است هدف افزایش یا محدود کردن گسترهی سلولهای مستعد برای انتقال ژن باشد. برای رسیدن به این هدف، پوشش پروتئینی ذاتی ویروس با پوشش پروتئینی ویروسهای دیگر و یا پروتئینهای شبیه سازی شده جایگزین میشود. ویروسهایی که پوشش پروتئینی آنها جایگزین میشود تحت عنوان عنوان ویروسهای pseudotyped شناخته میشوند. برای مثال مشهورترین وکتور رتروویروسی که پر کارآزماییهای ژندرمانی استفاده میشود ویروس نقص ایمنی میمونی (SIV) است که پوشش پروتئینی آن از G-پروتئینهای ویروس Vesicular stomatitis میباشد. این وکتور تحت عنوان VSV G-pseudotyped lentivirus شناخته میشود و گسترهی بسیار وسیعی از سلولها را آلوده میکند.
تلاشهای بسیاری برای محدود کردن گرایش وکتورهای ویروسی به یک یا تعداد کمتری از جمعیتهای سلولی انجام شده است، این پیشرفت به دانشمندان اجازه خواهد داشت کنترل بهتری روی وکتورها داشته باشند و بسیاری از نگرانیهای جامعه پزشکی را از بین خواهد برد. محدود کردن گرایش وکتورها از طریق پوششهای پروتئینی شبیه سازی شدهای صورت میگیرد که حاوی آنتیبادی هستند. ایگونه وکتورها نوید بخش ژن درمانیهایی با “وکتورهای جادویی” هستند.
مزایای وکتورهای ویروسی:
- این وکتورها در هدفگاری و ورود به سلولها خبره هستند.
- به کمک این وکتورها میتوان نوع خاصی از سلولها را هدف قرار داد.
- این وکتورها قابل تغییر هستند بنابراین خطری برای سلولهای میزبان ندارند.
محدودیتهای وکتورهای ویروسی:
- این وکتورهای قادرند تنها مقدار محدودی از ماده ژنتیکی را منتقل کنند بنابراین برخی ژنها بسیار بزرگتر از آن هستند که توسط وکتورهای ویروسی منتقل شوند.
- موجب پاسخ ایمنی در بیماران میشوند:
- مجدداً موجب ایجاد بیماری میشوند.
- سیستم ایمنی ویروس را غیرفعال کرده و مانع از انتقال ژن به سلولهای هدف میشود، و یا ژنها منتقل میشوند اما سیستم ایمنی سلولهای هدف حاوی ژن جدید را نابود میکند.
۱. adeno-associated virus یا AAV ها از ویروسهای DNAدار هستند و از آدنوویروسها و رتروویروسها سادهتر و کوچکتر هستند. بنابراین میزبان این ناقل در معرض حداقل مقدار مواد خارجی قرار میگیرد. از اینرو احتمال آنکه پاسخ ایمنی ایجاد کند بسیار کم است.

?