بیماری سیتیک فیبروزیس به دلیل جهش در ژن کد کنندهی پروتئين تنظیم کننده هدایت تراغشایی CF (CFTR) ایجاد میشود. این پروتئين در غشاء سلولی قرارداشته و جابجایی آب و یونهای منفی کلرید را به داخل و خارج سلول تنظیم میکند. عملکرد وسیع CFTR به این معنی است که این بیماری ارگانهای مختلفی را درگیر میکند؛ از جمله ریه، پانکراس، کبد، روده و دستگاه تناسلی. درصورت عدم حضور پروتئين عملکردی CFTR، بدن در ساخت عرق، مایعات گوارشی و موکوس دچار مشکل میشود. بسیاری از مبتلایان به دلیل مشکلات ریوی میمیرند. موکوسی که مسیرهای هوایی را در بیماران مبتلا به سیستیک فیبروزیس مسدود میکند، بیمار را نسبت به عفونت و زخم مستعد میکند. حتی در کشورهای پیشرفته نیز نیم از بیماران تا قبل از سن ۴۰ سالگی میمیرند.
مقاله مرتبط: سیستیک فیبروزیس
ژن CFTR در سال ۱۹۸۹ کشف شد، کشف این ژن و طبقه بندی سیستیک فیبروزیس به عنوان یک بیماری تک ژنی، سبب ایجاد انگیزه برای ژندرمانی این اختلال شد. به دلیل اینکه سیستیک فیبروزیس یکی از رایجترین بیماریهای ژنتیکی کشنده است (بیش از ۹۰ هزار نفر در سراسر جهان به این بیمای مبتلا هستند)، درمان مادامالعمر آن از طریق ژندرمانی از اهمیت بالایی برخوردار است. بین سالهای ۱۹۹۳ تا ۲۰۱۵، کارآزماییهای بالینی متعددی برای ارزیابی بیخطر بودن و عملکرد ملکولی طراحی و انجام شده است. از نظر تئوری ژندرمانی سیستیک فیبروزیس بسیار آسان است؛ زیرا یک اختلال ژنتیکی مغلوب و تک ژنی میباشد. به این معنی که دو نسخه از ژن جهش یافته CFTR برای ایجاد بیماری لازم است؛ به عبارتی انتقال تنها یک نسخه از ژن سالم CFTR به سلولها ریه، بیماری را درمان خواهد کرد. علاوه بر آن، ژندرمانی در ریه میتواند بدون نیاز به روشهای تهاجمی، تنها از طریق تنفس، صورت گیرد. اما محققان بدریافتند که ژندرمانی سیستیک فیبروزیس در عمل بسیار پیچیده است. این واقعیت که ها به راحتی از طریق مسیرهای هوایی با محیط بیرون در ارتباط هستند باعث شده است که مکانیسمهای دفاعی بسیار گستردهتری داشته باشند. وجود این مکتنیسهای دفاعی به این معنی است که سلولهای لایه خارجی مسیرهای هوایی (که دقیقاً سلولهایی هستند که نیاز بیشتری به کپی سالم از ژن CFTR دارند) عامل انتقال ژندرمانی را بیگانه تلقی کرده و آن را از بین میبرند. مشکل انتقال ژن در ریههای یک فرد مبتلا به سیستیک فیبروزیس حتی بدتر هم میباشد؛ زیرا ریههای این افراد موکوس سخت و چسبناکی دارد که مانع مضاغفی برای دسترسی به سلولهای لایه خارجی مسیرهای هوایی ایجاد میکند.
چالش دیگر در مقابل ژندرمانی سیستیک فیبروزیس این است که این ژندرمانی باید در طول زندگی بیماری تکرار شود؛ زیرا سلولهایی که کپی سالم ژن را دریافت میکنند پس از مدتی از بین رفته و جای آنها را سلولهای جدیدی میگیرد که دارای نقص ژنی هستند. همچنین سیستم ایمنی شخص پس از تکرار ژندرمانی توانایی شناسایی و مبارزه با وکتورهای ویروسی را به دست میآود. بدین ترتیب هرچه درمان بیشتر انجام گیرد اثر گذاری آن کمتر میشود. بنابراین برخلاف تئوری، در عمل سیستیک فیبروزیس یکی از چالشبرانگیزترین اهداف ژندرمانی است.
اصلاحکنندههای CFTR
با ظهور تصلاحکنندههای CFTR و پشرفت آنها چشمانداز درمان این بیماری به طور چشمگیری تغییر کرد. این اصلاحکنندهها بر روی پروتئین جهشیافتهی CFTR اثر کرده و عملکرد آن را بهبود میدهند. اما این دارو تنها روی نوع خاصی از جهش CFTR اثرگذار است. شناخته شدهترین اصلاحکننده CFTR ایواکافتور (ivacaftor) است که روی جهش کلاس III اثر میگذارد که شامل ۴ درصد از بیماران مبتلا به سیستیک فیبروزیس بودهو هزینهی بسیا بالایی (بالغ بر ۳۰۰٬۰۰۰ دلار آمریکا در سال) دارد. داروی دوم ترکیبی از ایواکافتور و ملکول دیگری است که با نام لوماکافتور (lumacaftor) شناخته میشود. این دارو رایجترین جهش (Phe508del) را هدف قرار میدهد که ۷۰ درصد از بیماران را شامل میشود با این حال این دارو اثرگذاری کمتری دارد.
انتخاب و طراحی وکتور مناسب
لیپوزومها: لیپوزومها برخلاف ویروسها سیستم ایمنی را تحریک نمیکنند بنابراین میتوانند بارها و بارها تزریق شوند. اما معایبی نیز دارند؛ از جمله اینکه در انتقال ماده ژنتیکی به هستهی سلول میزبان صد در صد کارآمد نیستند. محققان معتقند با افزایش دوز تزریقی میتوان اثرگذاری لیپوزومها را افزایش داد.
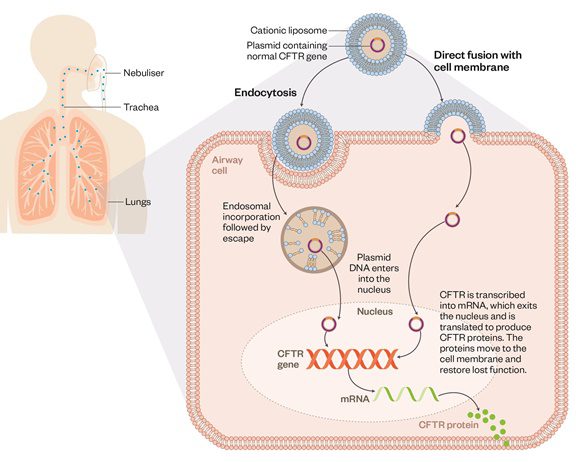
یک ژن CFTR سالم میتواند از طریق استنشاق لیپوزومهای نبولایز شده که با پلازمید DNA کدکنندهی پروتئين ترکیب شده است، انتقال یابد. لیپوزومها از طریق فرایند اندوسیتوز یا ادغام مستقیم با غشاء سلولی، انتقال ژن CFTR به داخل سلولهای مسیر هوایی را تسهیل میکنند. سپس پلازمید وارد هسته سلول شده و بیان ژن سالم و تولید پروتئينهای CFTR نرمال را القا میکند.
گروهی از محققان روی رویکردهای غیرویروسی دیگری مانند نانوذرات DNA کار میکنند. در این رویکرد ماده ژنتیکی به طور فشرده در داخل پوشش پلیمری بستهبندی شده است. این نانوذرات برای نفوذ به لاهی موکوسی ضخیم در بیمارن مبتلا به سیستیک فیبروزی، بسیار کارآمدتر سایر روشهاست.
لنتی ویروسها: لنتی ویروسها در ژندرمانی سایر بیماریها مانند نقص ایمنی ذاتی، عملکرد بسیار خوبی داشتهاند. به دلایل نامعلومی، این ویروسها پاسخ ایمنیای را که مانع تزریق چندباره میشود را تحریک نمیکنند؛ بنابریان میتوانند وکتور مناسبی برای ژندرمانی سیستیک فیبروزیس باشند. اصلاح ژن انجام شده از طریق لنتی ویروسها ماندگاری بیشتری دارد زیرا ماده ژنتیکی انتقال یافته توسط آنها در ژنوم سلول میزبان برای همیشه اینتگره (ادغام) میشود. اگرچه این مزیت از نظر ایمنی نگرانیهایی را نیز در پی دارد؛ زیرا ممکن است ماده ژنتیکی در نقطهی خطرناکی از ژنوم اینتگره شده و سبب ایجاد سرطان شود. کارآزمایی بالینی برای آزمایش ایمنی و اثرگذاری لنتی ویروسها نسبت به لیپوزومها، در تزریق به مسیرهای هوایی، در سال ۲۰۱۷ اغاز شده است.
در طول دههی گذشته، لنتی ویروسهای مختلفی از جمله ویروس HIV، برای ژندرمانی سیستیک یبروزیس آزمایش شده است. در یکی از این آزمایشها، قبل از تزریق وکتور به مسیرهای هوایی، از لیزوفسفاتیدیل کولین (LPC) استفاده میشود، ملکولی که باعث میشود اتصالات سخت (tight junctions) بین سلولی بری مدتی باز شوند. این عمل به وکتورهای ژندرمانی کمک میکند وارد لایه زیرین سلولهای مسیر هوایی شوند. همچنین دسترسی به سلولهای بنیادی را که سلولهای مسیر هوایی را بازسازی میکنند و به طور معمول در سطح زیرین مسیر هوایی قراردارند، راحتتر میکند. بدین ترتیب اگر بتوان وکتورهای ژندرمانی را وارد سلولهای بنیادی کرد، نقص ژنی با یک بار تزریق به طور دائمی اصلاح میشود. LPC ملکولی است که به طور معمول در ریهها وجود دارد. اگرچه باز کردن اتصالات سخت، حتی برای یک مدت کوتاه، بسیار خطرناک است، به خصوص در بیماران مبتلا به سیستیک فیبروزیس که اغلب ریههایشان آلوده به باکتری و عفونت است؛ با این حال این رویکرد هیچ آسیبی در حیوانات آزمایشگاهی بوجود نیاورده است اما تست آن روی انسانها همچنان نیاز به مدت زمان بیشتری دارد.
AAVها: این وکتورها در برخی از کارآزماییهای پیشین استفاده شده است اما نسبت به سایر وکتورها کارآمد نبوده است. در آزمایشهای اولیه از سروتایپها AAV2 برای ژندرمانی استفاده شده بود که در ورود به سلولهای مسیر هوایی موفق نبود. در حال حاضر گروه دیگری از محققان از سروتایپ AAV5 استفاده میکنند و پروموترهای قویتری را به کار میبرند. مطالعه روی حیوانات نشان میدهد که این وکتور نیز بیان ژن طولانی مدتی را القا میکند (حداقل ۱۵ ماه در موش). همچنین در این مطالعات تا کنون پاسخ ایمنی بر علیه این وکتور مشاهده نشده است.
به کمک تکنیکهای ملکولی جدید، استراتژیهای دیگری نیز برای اصلاح ژن CFTR وجود دارد. بستهبندی کردن نسخهی قعه قطعه شدهای از CFTR در داخل یک وکتور AAV یکی از این استراتژیهاست. در این فرایند قطعات کوچکی از پروتئین CFTR سالم که از طریق ماده ژنتیکی داخل وکتور کد شده است، روی CFTR جهشیافته داخل سلول میزبان اثرکردهو عملکرده آن را بهبود میبخشد. به عبارتی این استراتژی به سلولها کمک میکند داروی اصلاحکنندهی CFTR را خودشان بسازند. هر درمان انجام شده از طریق این استراتژي، تنها یک نوع جهش CFTR را هدف قرار میدهد. بنابراین این روش نیز برای برخی از جهشها ناکارآمد است.
روشهای دیگری نیز با استفاده از تکنولوژیهای ویرایش ژن از جمله کریسپر، TALEN، زینک فینگر نوکلئازها وجود دارد، این روشها نیز برای هر جهش اختصاصی عمل میکنند. اما ویرایش ژنی که DNA خود بیمار را اصلاح میکند مزایایی نسبت به اضافه کردن ژن سالم (استراتژی معمول در سایر ژندرمانیها) دارد؛ برای مثال اینکه چه زمانی و چه مقدار و چه شکلی از ژن باید بیان شود.
تنها استراتژی ویرایش ژن برای سیستیک فیبروزیس که تا کنون روی انسانها آزمایش شده است QR-010 است، ملکولی که توسط کمپاانی بیوتکنولوژی ProQR برای اصلاح جهش Phe508del طراحی شده است (که در حال حاضر در فاز اول کارآزمایی بالینی است). رویکرد این کمپانی نه تنها ویرایش DNA جهش یافته بلکه ویرایش mRNA نیز است که سلول برای ساخت پروتئين استفاده میکند.