نانوذرات پتانسیل عظیمی برای ایجاد شبکههای کارآمد دارورسانی دارند. در این مقاله قصد داریم تا با پیشرفتهای اخیر صورت گرفته در دنیای نانوتکنولوژی در این زمینه آشنا شویم.
در سالهای اخیر نانوپزشکی به یکی از پرتوجهترین شاخههای علمی تبدیل شده است که علت آن مربوط به پشت سر گذاشتهشدن مشکلات ژنتیکی و انتقال داروی معمول توسط آن است.
مقالهی مرتبط: نانوپزشکی؛ علم یا هنر؟
به طور عمومی، نانوذراتی که از آنها به عنوان ابزار دارورسانی استفاده می شود حداقل در یکی از ابعاد خود اندازهای کوچکتر از ۱۰۰nm دارند و شامل مواد قابل تجزیهی زیادی ازجمله پلیمرهای طبیعی یا مصنوعی، لیپیدها و فلزات هستند. این ذرات در مقایسه با مولکولهای بزرگتر جذب مناسبتری توسط سلولها داشته و به نظر میرسد برای انتقال و تحویل دارو مناسبتر هستند. (شکل ۱) در اقدامات درمانی، داروها به دو صورت قرار گرفته در ماتریکس ذره و یا متصل به سطح آن طراحی میشوند که در مورد دوم باید توجه زیادی به کنترل سرعت مناسب و سایر مؤلفههای مؤثر در ورود دارو به محیط بیولوژیکی داشت و امروزه نیز با در نظر گرفتن همهی این شرایط نانوذرات مختلفی در جهت تحقق اهداف درمانی کشف و استفاده میشوند.
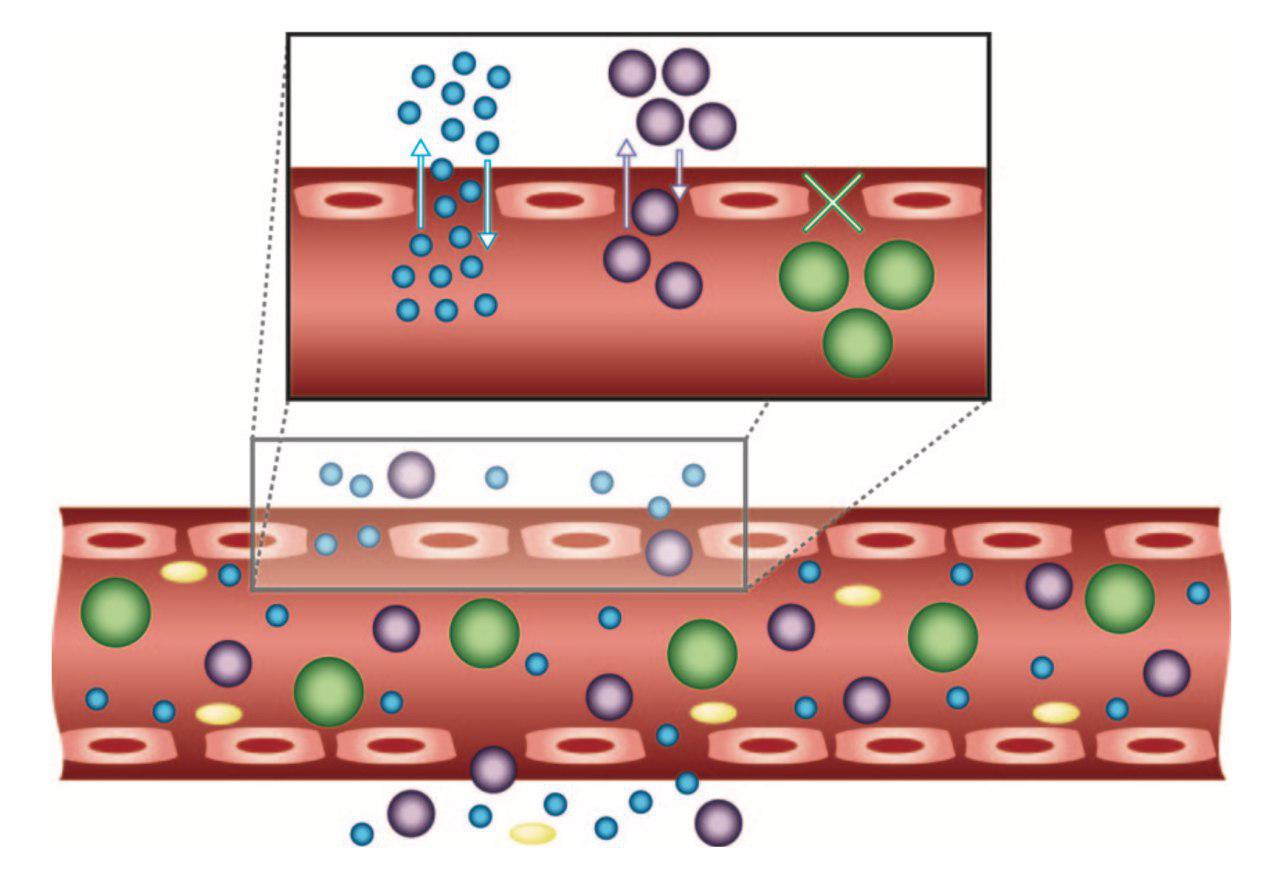
طراحی سیستمهای انتقال دارو بر پایهی نانوتکنولوژی
امکان استفاده از نانوذرات در جنبههای مختلف پزشکی مانند بهبود جذب داروهای کم حلالیت، هدفگیری داروها برای مکانی خاص، و در دسترسبودن دائمی آنها در بدن وجود دارد. شکل ۲، تصویری شماتیک از تفاوت میزان اثرگذاری داروهای هدفمند و غیرهدفمند را ارائه میکند.
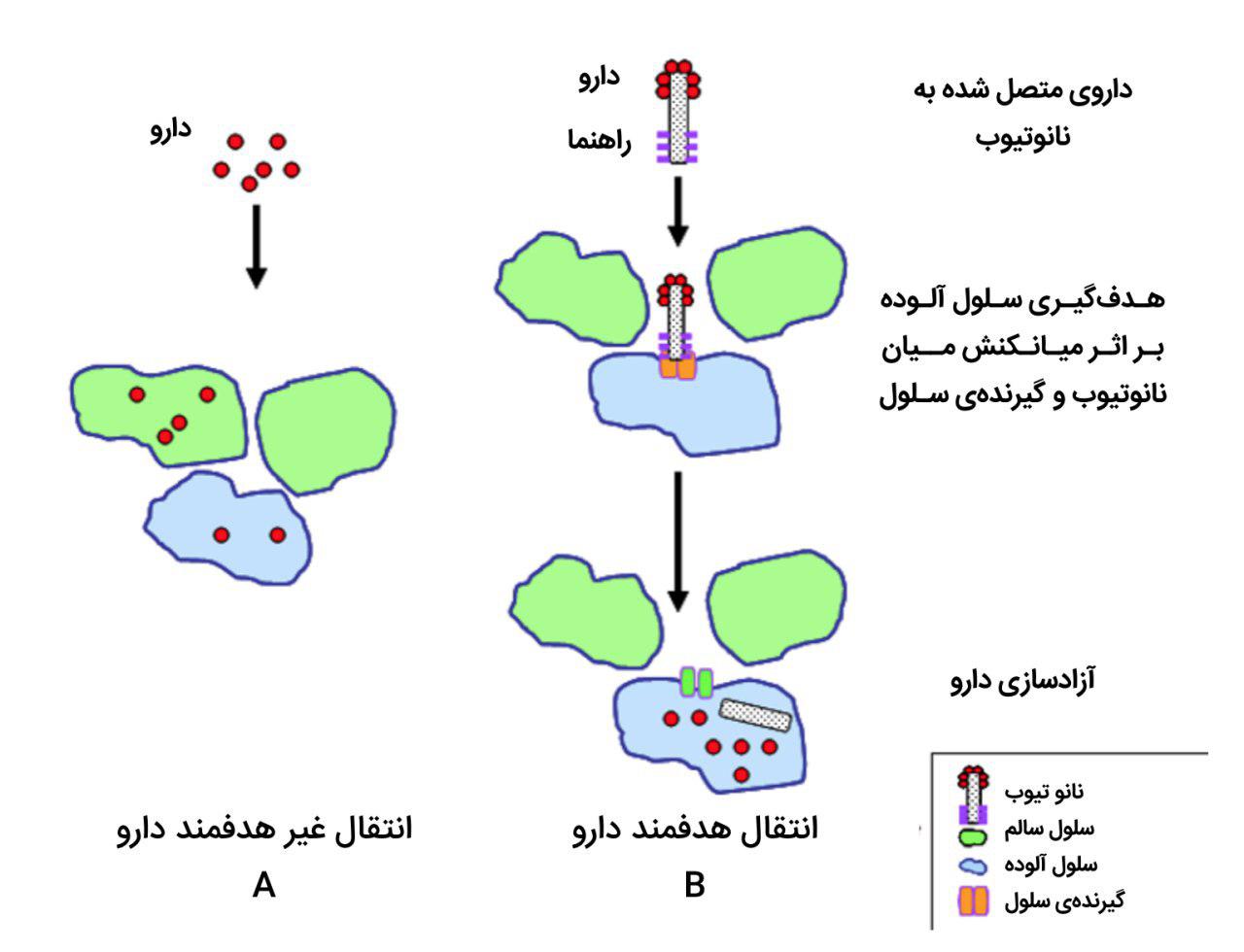
ابزار دارورسانی کلوئیدی مانند میسلها، لیپوزومها یا نانوذرات، به خصوص برای استفادهی آنها در درمان سرطان مشهور هستند و در حال حاضر نیز دانشمندان به بررسی بیشتر آنها می پردازند. تأثیرگذاری این سیستمها احتمالاً مربوط به اندازهی کوچک آنها، سمّیت کمترشان، مدت زمان کنترل آزادسازی دارو، و تجزیهپذیری آنهاست. در ادامه قصد داریم تا اهمیت این داروها در سه زمینهی بارز تحویل siRNA، درمان سرطان، و بهبود التهاب را بررسی کنیم.
تحویل siRNA به کمک نانوذرات
siRNA یا short interfering RNA ابزاری بسیار قدرتمند برای کنترل بیان ژنها از طریق اعمال تغییرات بسیار است که توسط بدن طراحی شده است. استفاده از درمانهای مبتنی بر نوکلئیک اسید در مرحلهی بالینی نیازمند تحقیقات و پیشرفتهای چشمگیر در این زمینه است. ازجمله مشکلات مطالعهی نحوهی عملکرد این روش در بدن، دشوار بودن امکان ردیابی و مشاهدهی رویدادهای سلولی در آن است که دانشمندان برای رفع آن از نانوذرات Chitosan قرارگرفته در داخل کپسولی از Quantum Dots برای انتقال siRNA ژنهای مختلف استفاده کردند.
راه دیگر غلبه بر این مشکل نیز علامتگذاری نانوذرات توسط مواد فلورسانس و مشاهدهی جذب و تجمع آنها توسط میکروسکوپ فلورسانس میباشد که تأثیر آن برروی کاهش بیان ژنهای سرطانی بررسی و پاسخ ۹۰ درصدی از آن مشاهده شد که درصد بسیار قابل توجهی است.
این یافتهها نشان از پتانسیل بالای استفاده از سیستمهای نوظهور وابسته به ذرات چیتوزان در درمان بیماریهای سیستمیک و موکوزی دارد.
هدفگیری سلولهای سرطانی با نانوذرات
امروزه سرطان به عنوان یکی از چالشبرانگیزترین بیماریها شناخته میشود که در میان انواع آن، سرطان مغز جزو سختترین بدخیمیها برای تشخیص و درمان به حساب میآید؛ زیرا عبوردادن مواد تصویربرداری و درمانی از سد خونی-مغزی و رساندن آنها به مغز بسیار دشوار است. یافتههای بسیاری حاکی از این هستند که نانوذرات قدرت رفع چنین مشکلاتی را دارند:
- آپولیپوپروتئین E یکی از موادی است که برای انتقال مواد در عرض سد خونی-مغزی پیشنهاد شده است؛ زیرا Loperamide که قدرت عبور از این مانع را ندارد، پس از اتصال به نانوذرات آلبومین خون و آپولیپوپروتئین E و تزریق مستقیم به مغزف دارای اثرات تسکین درد میباشد.
- Kopelman و همکارانش پروبی به نام PEBBLE را طراحی کردهاند که قدرت حمل تنوع بالایی از مواد گوناگون روی سطح خود و اعمال عملکردهای گوناگون را دارد.
- علت عمدهی نتیجهبخش نبودن شیمیدرمانیها مربوط به مقاومت دارویی ایجادشده توسط سلولها در اثر بیان پروتئینی به نام p-glycoprotein است. این پروتئین مسئول پمپکردن داروهای ضد سرطان به بیرون از سلول بلافاصله بعد از ورود آنهاست. تحقیقات جدید نشان میدهد که احتمالاً نانوذرات قادر به واردکردن داروهای ضد سرطان به داخل سلول، بدون تحریک پمپ p-glycoprotein باشند.
- ذرات هوشمند اکسید آهن سوپرمغناطیسی کنژوگهشده، میتوانند برای هدفگیری و تشخیص محل تومورهای مغزی اولیه استفاده شوند. این روش از دقت عمل بهتری نسبت به متدهای قبلی برخوردار است.
- آنژیوژنز عظیم اتفاقافتاده در تودههای سرطانی عامل پس پردهی رشد تهاجمی تومورهاست. در نتیجه یکی از مکانیسمهای مهار آنژیوژنز و رشد تومورها اصطلاحاً گرسنه نگهداشتن سلولها و مانعشدن از رگزایی در آنهاست که توسط نانوذرات روی میدهد.
مقالهی مرتبط: نانوتکنولوژی برای تشخیص زودهنگام و درمان سرطان کولورکتال
همهی این روشها ظرفیت نامحدود نانوذرات برای طراحی روش های نابود کردن سلول هاس سرطانی را نشان میدهد.
نانوسیستم های دخیل در التهاب
ساختارهای فیزیولوژیک دخیل در التهاب شامل ماکروفاژها و مولکولهای التهابی هستند که نانوذرات قادر به تنظیم آن از هر دو روش ذکرشده میباشند:
- هدفگیری ماکروفاژها برای کنترل التهاب: توانایی ماکروفاژها برای تشخیص سریع و دقیق ذرات بیگانه رویکردی منطقی برای هدفگیری اختصاصی ماکروفاژها توسط نانوذرات فراهم کرده است. ترشح ترکیبی از میانجیهای التهابی توسط ماکروفاژها، آنها را قادر میسازد تا میزان التهاب در بسیاری از بیماریها را معین کنند؛ در نتیجه این سلولها هدف فارماکوتیکال اصلی در بسیاری از بیماریهای انسانی و حیوانی محسوب میشوند. با وجود اینکه ماکروفاژها قادر به کشتن بیشتر انواع میکروبها هستند، میکروارگانیسمهای زیادی نیز همانند Leishmania SP و Toxoplasma Gondii توانایی مقاومت در مقابل در مقایب فعالیت فاگوسیتی ماکروفاژها را در خود ایجاد کردهاند. این پاتوژنها با ازبینبردن یکی از دستگاههای مولکولی طراحیشده توسط ماکروفاژ برای کشتن آنها، در درون لیزوزومهای تغییریافته لانهگزینی میکنند. در نتیجه انتقال مواد آنتیمیکروبی مبتنی بر نانوذرات به درون واکوئلهای داخل سلولی ماکروفاژها، میتواند روشی مؤثر برای حذف مخازن سلولی باشد. استفاده از این روش موجب تجمع دارو در واکوئلهای عفونیشده و همچنین کاهش اثرات جانبی مرتبط با آزادشدن سایتوکاینها میشود.
- هدف قراردادن مولکولهای التهابی: در دو دهۀ گذشته، بسیاری از مولکولهای چسبندگی سلولی کشف شدهاند. این مولکولها گلیکوپروتئینهایی در سطح سلول هستند که مانند گیرندههای بین سلولی، یا سلول و ماتریکس خارج سلولی عمل میکنند و برای مهاجرت صحیح مولکولهای التهابی نظیر نوتروفیلها و مونوسیتها به ارگانهای التهابی و ایجاد پاسخ التهابی موردنیاز هستند؛ با این وجود شواهد زیادی مبنی بر مهاجرت بیش از حد نوتروفیلها در التهاب ریه و تخریب بافت آن و مرگ یافت میشود. لذا از تلاشهای اصلی در این زمینه، کشف و تنظیم مقدار مناسب مهاجرت نوتروفیلها به ارگانهای التهابی است و پیشرفتهای اخیر صورتگرفته در زمینهی شناسایی مولکولهای چسبندگی سلولی، کمک به طراحی و توسعهی داروهای پپتیدی و پروتئینی برای درمان سرطان، بیماریهای خودایمنی و مشکلات قلبی از طریق انتقال اختصاصی داروها کردهاست.
جمعبندی
به نظر میرسد سامانههای انتقال دارو در مقیاس نانو، قدرت خوبی برای پشت سرگذاشتن بعضی از موانع دارورسانی اختصاصی در زمینهی بیماریهای التهابی و سرطان دارد؛ اما همچنان چالش تعیین ویژگیهای دقیق هدفهای مولکولی و اطمینان حاصلکردن از بیان داروها فقط در اندامهای موردنظر، به همران کاهش اثرات جانبی آنها همچنان پابرجاست. به هرحال، آینده با آغوشی باز و پر از رخدادهای شگفتانگیز در انتظار ماست.
این مقاله در BioMed Central منتشر شدهاست.
منبع
– Suri SS, Fenniri H, Singh B: Review Nanotechnology- Based Drug Delivery Systems. J Occup Med Toxicol 2007
