مهندسی ژنتیک فرایند دستکاری در ژنوم ارگانیسم است تا توالی خاصی تکثیر و بیان شود. این تغییر ممکن است در سطح یک جفت باز (A-T یا G-C)، حذف کامل یک ناحیه از DNA و یا افزودن نسخه دیگری از یک ژن باشد. همچنین ممکن است استخراج DNA از ژنوم یک ارگانیسم دیگر و ترکیب آن با ژنوم ارگانیسم موردنظر باشد. دانشمندان از مهندسی ژنتیک به منظور تقویت یا تغییر ویژگیهای موجود استفاده میکنند. این تکنیک میتواند در تمام ارگانیسمها از ویروس گرفته تا سلولهای گوسفند به کار رود. از کاربردهای مهندسی ژنتیک، تولید گیاهانی با ارزش غذایی بالاتر یا مقاوم به آفات است.
تاریخچه مهندسی ژنتیک
مهندسی ژنتیک ابتدائا به تکنیکهایی اشاره داشت که به منظور تغییر در ارگانیسمها از طریق وراثت و تولیدمثل به کارگرفتهمیشدند. در در نیمه دوم قرن بیستم این عبارت اختصاصا برای تکنولوژی DNA نوترکیب (recombinant DNA technology) استفاده شد. طی این فرایند، مولکولهای DNA از دو یا چند منبع، با همدیگر ترکیب شده و به درون ارگانیسم میزبان وارد میشوند تا تکثیر یابند.
امکان انجام مهندسی ژنتیک، با کشف آنزیمهای محدودکننده در سال ۱۹۶۸ توسط Werner Arber، میکروبشناس سوئیسی، فراهم شد. در سال ۱۹۶۹ میکروبشناس آمریکایی، Hamilton O. Smith، آنزیمهای محدوکننده نوع ۲ را جداسازی کرد. این آنزیمها برخلاف آنزیمهای محدودکننده نوع اول که در نقاط تصادفی ایجاد برش میکردند، میتوانستند نقاط خاصی از DNA را برش دهند. از این رو برای استفاده در مهندسی ژنتیک مناسب تشخیص داده شدند. Daniel Nathans، زیستشناس آمریکایی، با ادامه دادن پژوهشهای Smith، به پیشرفت تکنولوژی DNA نوترکیب کمک کرد و توانست نشان دهد که آنزیمهای محدودکننده نوع ۲ میتوانند در مطالعات ژنتیکی مفید واقع شوند. مهندسی ژنتیک بر پایه نوترکیبی در سال ۱۹۷۳ توسط Stanley Cohen و Herbert Boyer ارائه گردید. آنان برای نخستین بار DNA را به قسمتهایی تقسیم کردند، قطعات مختلف را به هم متصل کردند و ژنهای جدید را وارد باکتری E. coli کردند تا تکثیر یابند.
نسل بعدی مهندسی ژنتیک که در قرن ۲۱ ظهور کردهاست، بر مبنای ویرایش ژن (gene editing) میباشد. ویرایش ژن از تکنولوژی CRISPR-Cas9 بهره میگیرد و امکان تعیین توالی ژنتیکی ارگانیسم را با ایجاد تغییرات ویژه در DNA آن فراهم میکند. ویرایش ژن کاربردهای فراوانی از جمله ایجاد تغییر ژنتیکی در محصولات زراعی، دامها و حیوانات آزمایشگاهی مانند موش ها دارد. اصلاح خطاهای ژنتیکی که مرتبط با بیماریها هستند، به عنوان یک روش درمانی بالقوه در ژندرمانی مطرح است.
مقاله مرتبط: مروری بر روند توسعه سیستم اصلاح ژنی کریسپر از ابتدا تاکنون
مهندسی ژنتیک چگونه انجام میشود؟
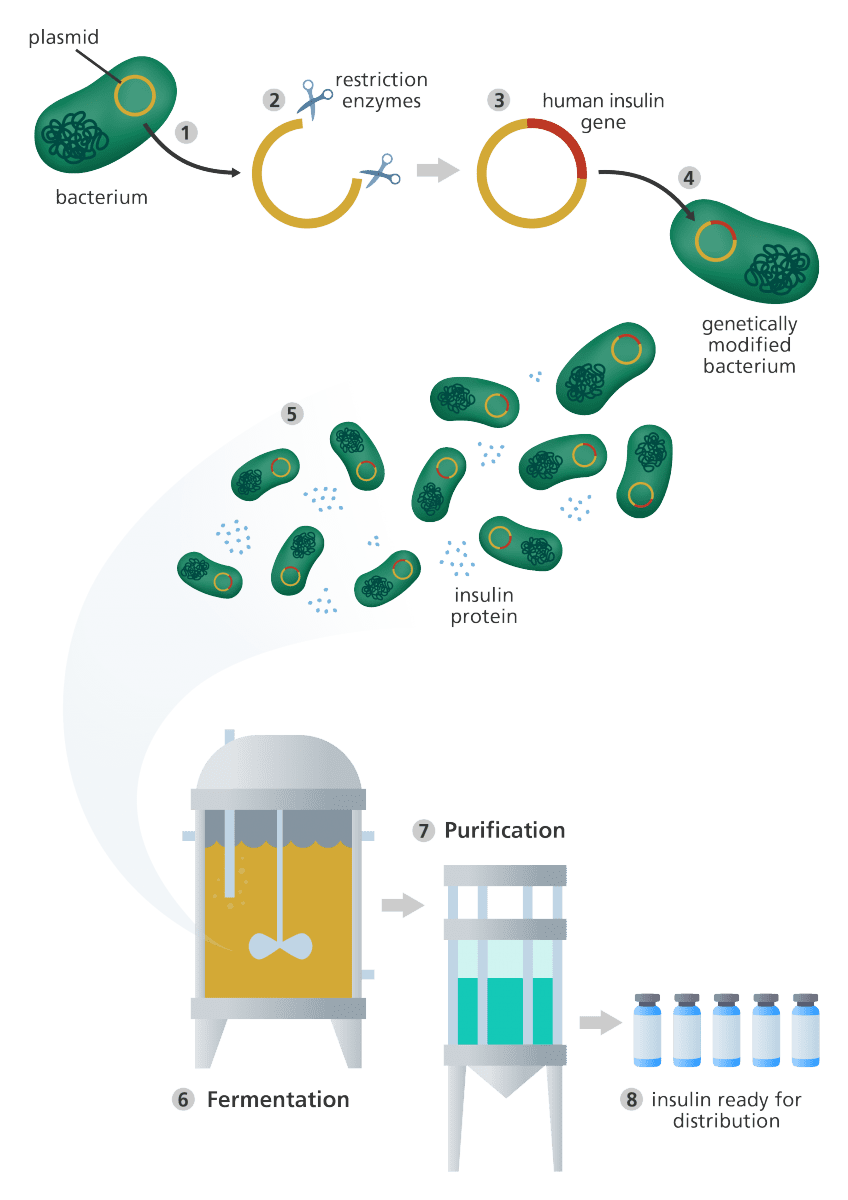
برای اینکه توضیح فرایند مهندسی ژنتیک آسانتر شود، از مثال انسولین استفاده میکنیم.
- انسولین هورمونی است که سطح قند خون بدن را تنظیم میکند.
- این هورمون در حالت طبیعی در پانکراس تولید میشود.
- در افراد مبتلا به دیابت نوع ۱، تولید انسولین مختل میشود. در نتیجه این بیماران باید با تزریق ااین هورمون، سطح قند خون خود را در حالت نرمال نگه دارند.
- با استفاده از مهندسی ژنتیک میتوان نوعی از انسولین را از مخمر و باکتریهایی مانند E. coli تهیه کرد که شباهت فراوانی به انسولین انسانی دارد.
- این انسولین، که هومولین نام دارد، در سال ۱۹۸۲ برای استفاده انسانی مجوز پیدا کرد.
مهندسی ژنتیک و تولید انسولین در باکتری
فرایند مهندسی ژنتیک
- تکه کوچکی از DNA حلقوی به نام پلاسمید از سلول باکتری یا مخمر استخراج میشود.
- پلاسمید سپس توسط آنزیمهای محدود کننده برش داده میشود.
- ژن انسولین انسانی در ناحیه برش به پلاسمید متصل میشود. این پلاسمید اکنون از لحاظ ژنتیکی تغییر یافته است.
- پلاسمید تغییریافته به سلول باکتری یا مخمر دیگری انتقال داده میشود.
- سلول سپس به سرعت تقسیم شده و تولید انسولین را آغاز میکند.
- برای تولید تعداد فراوانی از سلولها، باکتریها یا مخمرهای تغییر یافته به ظرفهای تخمیری بزرگی که حاوی مواد مورد نیازشان است، منتقل میشوند. هر چه سرعت تقسیم سلولها بیشتر باشد، انسولین بیشتری تولید خواهد شد.
- پس از تکمیل تخمیر، مخلوط حاصل از فیلتر عبور دادهمیشود تا انسولین به دست آید.
- انسولین سپس خالصسازی شده و به صورت قابل استفاده برای بیماران دیابتی بستهبندی میگردد.
اجزای اصلی فرایند مهندسی ژنتیک
- وکتورها: برای انتقال توالی موردنظر به ارگانیسم گیرنده مورد نیاز هستند؛
- توالی DNA موردنظر که باید تقویت و بیان شود؛
- آنریمهایی مانند آنزیمهای محدودکننده: برای ایجاد برش در DNA به کار میروند؛
- آنزیم DNA لیگاز: برای الحاق توالی موردنظر به وکتور مورد نیاز است.
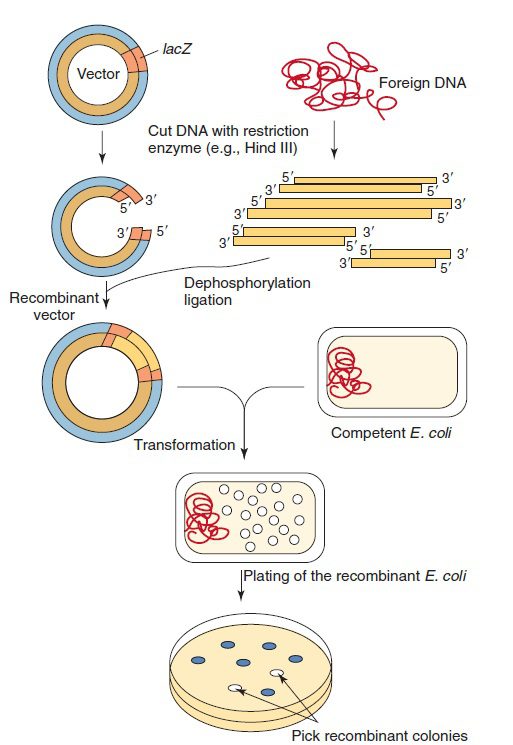
از سادهترین روشهای کلون کردن DNA، الحاق DNA خارجی به ژنوم یک واحد ژنتیکی خودتکثیر شونده یا self-replicating است که وکتور (ناقل) نام دارد. وکتورها باید توانایی پذیرش DNA خارجی را داشتهباشند و بتوانند در درون سلول میزبان تکثیر شوند. پلاسمیدها، باکتریوفاژها و کاسمیدها (cosmids) که ترکیبی از پلاسمیدها و فاژها هستند، از انواع وکتورها میباشند. حداکثر اندازه قطعه DNA منتقل شده به پلاسمیدها حداکثر ۲۰ کیلوباز، فاژها تا ۲۵ کیلوباز و کاسمیدها تا ۴۵ کیلوباز میباشد. وکتورهای کلون شونده باید بهگونهای مهندسی شوند که دارای مکانی برای ورود DNA بیگانه، راهی برای گزینش باکتریهای دارای پلاسمید و روشی برای تشخیص پلاسمیدهای حاوی DNA مورد نظر باشند.
پلاسمید وکتوری است که به صورت گسترده برای کلون کردن ژن مورد استفاده قرار میگیرد و یک مولکول DNA حلقوی، دورشتهای و کوچک است. E. coli F plasmid و BAC (Bactrial Artificial Chromosome) که از مشتقات F plasmid است، از پلاسمیدهای پرکاربرد هستند. این مولکولها بزرگ بوده و تنها یک یا دو نسخه از آنها در هر سلول E. coli وجود دارد. این ویژگی باعث کاهش احتمال نوترکیبی با سایر پلاسمیدها و تغییر قطعه DNA مورد نظر میشود. این پلاسمیدها همچنین میتوانند قطعات DNA بلندتری را حمل کنند.
DNAهایی که باید کلون شوند را میتوان با خالصسازی (purification) DNA کروموزومی از سلولها، ویروسها و سایر پلاسمیدها و یا با تکثیر انتخابی توالی مورد نظر از طریق PCR، تهیه کرد.
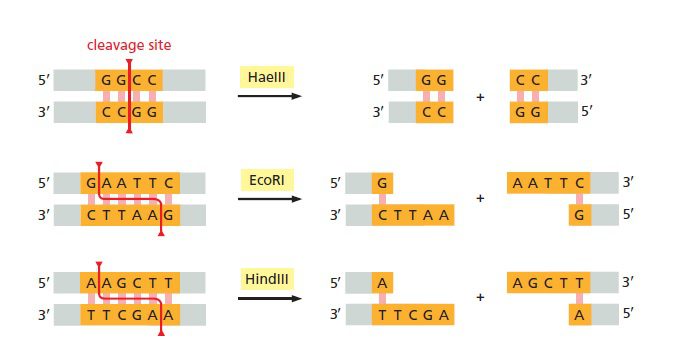
هم وکتور و هم DNA خارجی توسط آنزیم محدودکننده یکسانی برش دادهمیشوند. هر آنزیم محدودکننده توانایی شناسایی توالیهای پالیندروم خاصی را داشته و پس از برش میتواند انتهای چسبنده (sticky) و یا کور (blunt) را ایجاد نماید. در تصویر زیر، هر دو رشته DNA در نقاط خاصی درون توالی هدف (قسمت نارنجی) برش دادهشدهاند. برخی آنزیمها مانند HaeII، یک برش مستقیم را در عرض ساختار دو رشتهای ایجاد کرده و باعث به وجودآمدن دو مولکول DNA با انتهای کور (blunt) میشوند. سایر آنزیمها مانند EcoRI و HindIII برشهایی با انتهای چسبنده ایجاد میکنند. انتهاهای چسبنده توالیهای تکرشتهای و کوتاهی هستند که به اتصال مجدد مولکولهای برشدادهشده کمک میکنند. این اتصال از طریق جفتشدن بازهای مکمل صورت میگیرد. امروزه صدها نوع آنزیم محدودکننده مختلف شناسایی شده و به صورت تجاری تولید میشوند.
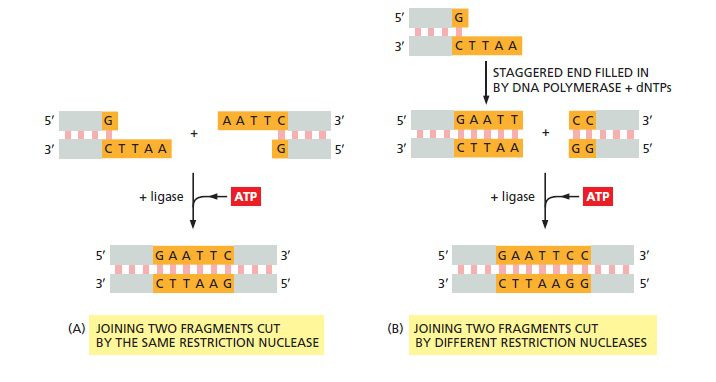
اتصال وکتور به مولکول DNA خارجی تحت تاثیر آنزیم لیگاز، مولکول DNA نوترکیب را ایجاد میکند. ATP انرژی موردنیاز برای ایجاد مجدد پیوند بین فسفات و قند را فراهم میکند. DNA لیگاز میتواند به آسانی دو قطعه DNA تولید شده توسط یک آنزیم محدود کننده را به همدیگر متصل کند. در صورتیکه آنزیم محدودکننده انتهای چسبنده ایجاد کند (مانند EcoRI)، جفت شدن رشتههای مکمل میتواند اتصال توسط لیگاز را تسهیل نماید. آنزیم لیگاز همچنین میتواند برای اتصال قطعاتی استفاده شود که توسط آنزیمهای محدودکننده متفاوتی تولید شدهاند؛ مانند EcoRI و HaeII. در این حالت، ابتدا از مخلوط DNA پلیمراز و دئوکسیریبونوکلئوزیدتریفسفاتها (dNTPs) برای پر کردن نواحی چسبنده تولیدشده توسط EcoRI استفاده میشود.
DNA نوترکیب تولیدشده، به درون سلول میزبان مانند باکتری E. coli که موقتا به DNA نفوذپذیر شدهاست، وارد میشود. با رشد و تکثیر سلولها پلاسمیدهای نوترکیب نیز تکثیر شده و نسخههای فراوانی از DNA مورد نظر ایجاد میشود. برای شناسایی باکتریهای حاوی پلاسمید از مقاومت آنتیبیوتیکی مثل مقاومت به آمپیسیلین استفادهمیشود. تکنیکهای غربالگری متعددی برای تشخیص باکتریهای حاوی DNA نوترکیب مناسب وجود دارد. بهعنوان مثال، جایگاه چندگانه کلونینگی (multiple cloning site= توالیای که میتواند توسط چندین آنزیم محدودکننده برش دادهشود) که مخصوص ورود DNA خارجی است، میتواند بخشی از ژن lacZ اپران lac باشد. قرار گرفتن DNA خارجی در داخل lacZ، این ژن را غیر فعال کرده و جلوی سنتز β-galactosidase تحت هدایت پلاسمید را در سلول گیرنده میگیرد. این امر موجب شکستهشدن کروموفور موجود در محیط کشت توسط این آنزیم و تولید کلونیهای سفید میشود. در صورتیکه DNA خارجی در این قسمت از پلاسمید قرار نگرفتهباشد، کلونیها به رنگ آبی خواهند ماند.
برای جدا کردن DNAهای خارجی از سایر مولکولهای DNA، ابتدا سلولها لیز و پلاسمیدها جدا میشوند. سپس همان آنزیم محدودکنندهای که قبلا استفادهشدهبود، برای برش مجدد DNA بهکارمیرود. در مرحله بعدی از ژل الکتروفورز به منظور جدا کردن DNA مورد نظر از پلاسمید استفاده میشود.
کاربرد مهندسی ژنتیک چیست؟
مهندسی ژنتیک درک ما را از عملکرد و سازمانبندی ژنها افزایش داده است. با استفاده از تکنیک DNA نوترکیب باکتریهایی تولید شدهاند که توانایی سنتز انسولین انسانی، هورمون رشد انسانی، اینترفرون آلفا، واکسن هپاتیت B و سایر مواد سودمند از لحاظ پزشکی را دارند.
مهندسی ژنتیک کاربردهای مفیدی در تحقیقات علمی، کشاورزی و تکنولوژی دارد. در گیاهان مهندسی ژنتیک برای افزایش ارزش غذایی گیاهان، بهبود چرخه نیتروژن و مقاومت آنها در برابر آفات و نیز افزایش میزان رشد محصولاتی همچون گوجهفرنگی، سیبزمینی و برنج استفاده میشود. در سال ۱۹۹۴، نخستین مواد غذایی تولید شده بامهندسی ژنتیک، برای مصرف عموم موجود شدند.
بیماریهای ژنتیکی نیز میتوانند از طریق مهندسی ژنتیک و با جایگزین کردن ژنهای معیوب با ژنهای سالم، درمان شوند. از کاربردهای مهندسی ژنتیک در جانوران، تولید گوسفندانی است که شیرشان محتوی پروتئین درمانی خاصی برای درمان فیبروز سیستیک و یا کرمهایی است که به دانشمندان در درک بیماری آلزایمر کمک میکنند.
کرم C. elegans تنها حدود ۳۰۰ سلول در کل سیستم عصبیاش دارد. این ویژگی از آن مدلی ساده برای مطالعه بیماری آلزایمر ساختهاست. این کرم همچنین تقریبا شفاف است. به همین علت با لیبل دار کردن سلولهای عصبی آن با پروتئین سبز فلوئوروسنت (GFP)، مشاهده موقعیت و فعالیت ساختارها و پروتئینهای فراوانی زیر میکروسکوپ ممکن میشود. محتوای ژنتیکی C. elegans میتواند به منظور تولید پروتئینهایی که دانشمندان میخواهند مطالعه کنند، به آسانی دستکاری شود.
در انسانها، ژن APP مسئول کد کردن پروتئین آمیلوئید است. پلاک های پروتئین آمیلوئید مشخصه بیماری آلزایمر هستند. پس برای مطالعه آلزایمر، محققان سلولهای کرم را بهگونهای مهندسی میکنند تا حاوی ژن APP و درنتیجه بیماری آلزایمر شوند. با لیبل دار کردن پروتئینهای APP تولید شده در کرم با GFP، دانشمندان مشاهده کردند که تمام سلولهایی که با APP تماس داشتند، با پیر شدن کرم میمیرند. محققان با استفاده از این روش قادر شدند روند پیشرفت بیماری آلزایمر را در کرم مشاهده و از آن برای درک عملکرد پروتئین APP در انسان کمک بگیرند.
با اینحال، نگرانیهای عمدهای در مورد این دستاوردها ایجاد شدهاست؛ از جمله اینکه ممکن است این دستکاریها باعث ظهور ویژگیهای ناخواسته و خطرناکی در میکروارگانیسمهای تغییر یافته شوند؛ مانند مقاومت به آنتیبیوتیکها، تولید توکسینها و بیماریزایی. همچنین استفاده از تکنیک ویرایش ژن در انسانها، پرسشهای اخلاقی بسیاری را خصوصا در مورد استفاده احتمالی از آن برای تغییر ویژگیهایی همچون هوش و زیبایی بهوجودآوردهاست.