در طیف سنجی جرمی تکنیک جذب و یونش لیزری با ماتریکس matrix-assisted laser desorption/ionization (MALDI) یک تکنیک یونیزاسیون است که از انرژی لیزر با جذب ماتریکس برای ایجاد یون از مولکول های بزرگ با کمترین میزان تجزیه استفاده می شود.
روش matrix-assisted laser desorption/ionization-time of flight mass spectrometry یا MALDI-TOF MS روشی است که اخیرا به عنوان یک تکنیک قدرتمند برای شناسایی میکروارگانیسم ها ظهور کرده است. در مقایسه با روش های تشخیصی معمول در آزمایشگاه های میکروبیولوژی که بر تست های بیوشیمیایی استوار هستند و نیاز به زمان انکوباسیون طولانی دارند٬ این روش مزیت تشخیص باکتری ها و قارچ ها به طور مستقیم از کلونی باکتری ها و قارچ های رشد یافته در محیط کشت را دارد. تشخیص در این روش طی چند دقیقه و با مراحل ساده اتفاق می افتد. قسمتی از کلونی میکروب نامشخص در هدف نمونه قرار داده می شود و با ماتریکس پوشانده می شود. طیف های جرمی تولید شده توسط نرم افزار های اختصاصی آنالیز شده و با پروفایل های ذخیره شده مقایسه می گردد.
تشخیص گونه ها توسط این روش بسیار سریع تر ٬ صحیح تر و ارزان تر از سایر روش های مبتنی بر تست های بیوشیمیایی یا ایمونولوژیکی است. بنابراین روش MALDI/TOF در حال تبدیل به روش استاندارد تشخیص گونه ها در آزمایشگاه های میکروبیولوژی است.
مزیت دیگر این روش امکان تخمین حساسیت آنتی بیوتیکی باکتری هاست. حداکثر طیف سنجی یک کلونی میکروبی باکتری می تواند مقاومت به متی سیلین را در استافیلوکوکوس اورئوس پیش بینی کند. همچنین می توان کارباپنماز را در سویه های مقاوم به کارباپنم انتروباکتریاسه شناسایی کرد (شامل اسنیتوباکتر بومانی و کلبسیلا پنومونیه) . با این وجود بیشتر پروتئین های دخیل در مقاومت آنتی بیوتیکی بزرگتر از محدوده تشخیص این روش هستند.
تاریخچه
طیف سنجی جرمی (MS) روشی است که دهه ها در شیمی استفاده شده است. در سال ۱۹۷۵ Anhalt و Fenn پیشنهاد استفاده از این روش در شناسایی باکتری ها را دادند. زیرا آنها مشاهده کردند طیف جرمی محصولات خارج شده از گونه های مختلف باکتری با هم متفاوت است. در دهه ۱۹۸۰ تکنیک های یونیزاسیون و جذب که باعث تولید یون های بیومارکرهای مولکولی از میکروارگانیسم ها می شوند گسترش یافت و راه را برای نمایه گذاریه (profiling) باکتری ها هموار کرد. آزمایش های اولیه براساس فرایند های یونیزاسیون یک بیومولکول بودند که باعث تولید مولکول های بیومارکر از جرم های مولکولی پایین به طور عمده لیپید های باکتریایی شد. در اواخر دهه ی ۱۹۸۰ ٬ Tanaka و Fenn به لطف گسترش تکنیک یونیزاسیون MALDI (تکنیک جذب و یونش لیزری با ماتریکس) و ESI (یونیزاسیون الکترواسپری) توانستند آنالیز بیومولکول های بزرگ مثل پروتئین های intact را ممکن سازند. در سال ۱۹۹۶ انگشت نگاری های طیفی matrix-assisted laser desorption/ionization-time of flight (MALDI-TOF) از یک سلول کامل باکتریایی گرفته شد (توسط Holland و همکارانش).
امروزه MALDI-TOF MS یکی از روش های سریع ٬ صحیح و حساس شناسایی میکروب ها (باکتری٬ قارچ و ویروس) است.
تکنیک MALDI-TOF MS ( چگونگی و روش شناسی)
یونیزاسیون MALDI یک تکنیک یونیزاسیون soft ( با کمترین مقدار تجزیه و fragmentation)می باشد که باعث یونیزاسیون و تبخیر بیومولکول های بزرگ غیر فرار مثل پروتئین های intact می شود. در این روش به طور عمده یون های تک بار (z=1) تولید می شود ؛ در نتیجه نسبت جرم به بار (m/z) ماده آنالیز شونده با ارزش جرمی آن مطابق خواهد بود. هر MALDI-TOF MS از سه بخش تشکیل شده است:
- اولین بخش یک مخزن یونی است که باعث یونیزاسیون شده و یون های مولکول نمونه را به فاز گازی می برد.
- بخش دوم٬ یک آنالیز کننده جرم است که باعث جداسازی یون ها براساس نسبت جرم به بار می گردد.
- آخرین بخش یک دستگاه تشخیص و ارزیابی است که یون های جداشده را بررسی می کند.
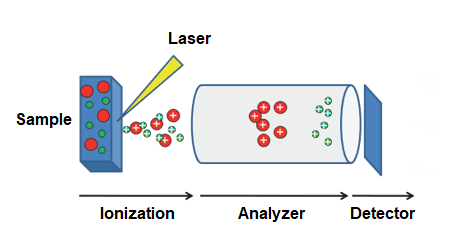
روش شناسی تکنیک MALDI یک فرایند سه مرحله ای است:
- ابتدا نمونه با یک ماترکس مناسب مخلوط می شود و در یک صفحه فلزی قرار داده می شود.
- سپس یک لیزر پالس دار و ضربه ای به نمونه تابانده می شود که باعث واجذبی نمونه و ماده ماتریکس می گردد.
- در نهایت مولکول های ماده آنالیز شونده توسط پروتون دهی یا ازدست دادن پروتون در بخار داغ گاز های واجذب شده یونیزه می شوند و سپس شتاب گرفته و به نقطه ای می رسند که طیف سنج جرمی می تواند آن ها را آنالیز کند.
ماتریکس
ماتریکس از مولکول های کریستالی شده (متبلور) تشکیل یافته است. سه نوع ماتریکس به طور عمده در این روش مورد استفاده قرار می گیرند:
- sinapinic acid : سه و پنج – دی متوکسی- چهار – هیدروکسی سیناپینیک اسید
- α-CHCA: آلفاسیانو – چهار – هیدروکسی سیناپینیک اسید
- DHB : دو و پنج – دی هیدروکسی بنزوئیک اسید
محلول یک از این سه مولکول اغلب در مخلوطی از آب تصفیه شده و یک حلال ارگانیک مثل استونیتیریل (ACN) یا اتانول تهیه می شود. یک منبع یونی مثل تری فلورو استیک اسید (TFA) نیز معمولا برای تولید یون های [M+H] اضافه می شود.
تعیین ترکیبات ماتریکس مناسب تا حدی توسط آزمون و خطا مشخص می شود؛ اما بر اساس رعایت بعضی از اصول مولکولی خاص می باشد. ماتریکس ها وزن مولکولی نسبتا کمی دارند ( تا به آسانی تبخیر شوند) اما به اندازه ای بزرگ هستند که طی آماده سازی نمونه یا در طیف سنج جرمی تبخیر نگردند. معمولا خاصیت اسیدی دارند و بنابراین به عنوان منبع پروتون در یونیزاسیون ماده آنالیز شونده به کار می روند ( هرچند ماتریکس های بازی نیز ممکن است به ندرت استفاده شوند). این مواد قدرت چذب نوری بالایی دارند ( هم در محدوده UV و هم IR) ؛ بنابراین به سرعت تابش لیزر را جذب می کنندو در این کار کارامدی بالایی دارند. این کارامدی به طور عمده با ساختار های شیمیایی که شامل چندین پیوند دوگانه کنژوگه می باشد ٬ همراه است. عملکرد ماتریکس ها با مولکول های قطبی تقویت شده و باعث کارکرد آن ها در محلول های مایع می شود. آن ها به طور معمول کروموفور نیز دارند.
محلول ماتریکس با ماده آنالیز شونده مثل نمونه پروتئین مخلوط می شود. وجود محلولی از آب و حلال ارگانیک باعث می شود که هم مولکول های هیدروفوب و هم هیدروفیل (محلول در آب) در محلول حل شوند. این محلول در صفحه MALDI قرار داده می شود ( که به طور معمول یک صفحه فلزی است که برای این هدف طراحی شده است). حلال ها تبخیر شده و تنها ماتریکس دوباره متبلور شده (recrystallized) ٬ همراه با مولکول های ماده آنالیز شونده که با کریسنتال های MALDI ادغام شده اند ٬ باقی می ماند. گفته می شود که ماتریکس و ماده آنالیز شونده ٬ دچار هم تبلوری ( co-crystallization ) می شوند. co-crystallization یک مسئله بسیار مهم در انتخاب ماتریکس مناسب است.
تشخیص باکتریایی
تکنولوژی MALDI-TOF MS این امکان را فراهم می کند که بسیاری از گونه های باکتری ها در زمان کمی (۱۲-۲۴ ساعت تا چند دقیقه) با کمترین مقدار میکروبی (۱۰۴-۱۰۶ CFU) شناسایی شوند. اما تکنیک های آزمایشگاهی روتین برای تشخیص باکتری ها در آزمایشگاه به طور عمده بر اساس تست های بیوشیمیایی ٬ میکروسکوپی ٬ ویژگی های فنوتیپی باکتری ها یا به طور جایگزین بیولوژی مولکولی است. این روش ها نیازمند تجربه و تخصص بوده و وقت گیر هستند.
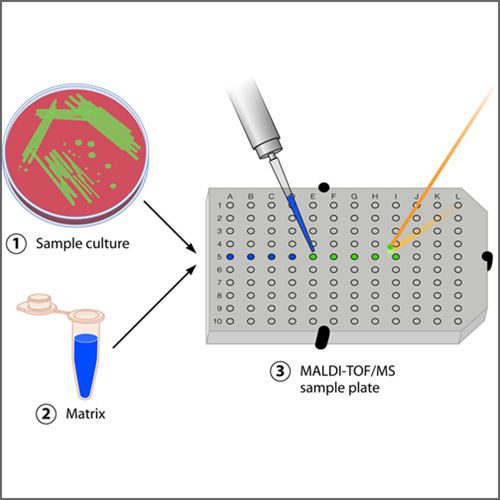
کلونی های ایزوله باکتریایی توسط وسیله ای استریل از محیط کشت آگار برداشته می شوند و در فیلم نازکی اسمیر می گردند. سپس با ماتریکس CHCA یا DHB پوشانده می شوند و در طیف سنج جرمی قرار داده می شوند تا اطلاعات حاصل از آنها به دست آمده و ثبت شود. طیف های ثبت شده با اطلاعات موجود در پایگاه داده مقایسه می شود و در مدت کوتاهی نتایج حاضر می گردد. دو سیستم نتایج قابل مقایسه ای تولید می کنند و در مجموع عملکرد تشخیص توسط MALDI-TOF به طور عمده ای توسط سیستم های BD Phonix ( France) و Vitek-2 (France) بهتر است.
گونه هایی که دارای تفاوت اندکی در توالی پروتئین های ریبوزومی خود هستند ٬ می توانند توسط روش MALDI-TOF MS به اشتباه تشخیص داده شوند. این گونه ها شامل shigella ٬ E.coli ؛ بعضی از سویه های Stenotephomonas ٬ Propionibacterium acnes یا Streptococcus Pneumoniea و اعضایی از S.oralis/mitis می باشد. تا به امروز صحت تشخیص در این روش تا حد زیادی به مقادیر اطلاعات وارد شده در پایگاه داده بستگی دارد. نسخه به روز شده رفرنس های پایگاه داده برای بهبود عملکرد تشخیص در روش MALDI-TOF MS مورد نیاز است. بهبود اطلاعات داده شده به پایگاه داده با طیف های چندگانه گونه های با ویژگی ها مشخص باعث افزایش قدرت تشخیص تا نزدیک برای نیسریا ٬ کلستریدیا ٬ مایکوباکتریا ٬ سالمونلا ٬ استرپتوکوکوس ویریدانس ٬ هلیکوباکتر پیلوری و کامپلیوباکتر خواهد شد. تشخیص قابل اعتماد و طبقه بندی مایکوباکتریای کشت شده نیز با پایگاه داده با اطلاعات کافی می تواند حاصل شود.
تعیین مقاومت آنتی بیوتیکی
تکنولوژی MALDI-TOF MS فق های جدیدی در زمینه میکروبیولوژی تشخیصی و تعیین میکروارگانیسم های مقاوم گشوده است. یکی از چالش های مقاومت آنتی بیوتیکی ٬ استافیلوکوکوس اورئوس مقاوم به متی سیلین (MRSA) است. بعضی از مطالعات توانایی طیف سنجی جرمی در افتراق بین استافیلوکوکوس اورئوس حساس به متی سیلین و مقاوم به آن را نشان داده اند.
با توجه به تشخیص بتا-لاکتاماز تولید شده در انتروباکتریاسه ٬ یکی از موضوعات جالبب توجه شناسایی محصولات فرعی تولید شده توسط هیدرولیز حلقه های بتالاکتام می باشد. هیدرولیز توسط آنزیم های باکتریایی که در نهایت حاضر هستند و بعد از انکوباسیون ( یک تا سه ساعت) یاکتری با آنتی بیوتیک ٬ جهت انجام تست ٬ انجام می شود. تغییری که در جرم ترکیبات آنتی بیوتیکی ایجاد می شود می تواند توسط طیف سنج جرمی MALDI-TOF شناسایی شده و حضور بتالاکتاماز را تعیین کند.
