در یک خیابان شلوغ هزاران نفر درحال تردد هستند، افرادی با پوست تیره یا روشن، چاق و یا لاغر، ساکت یا پر هیاهو،… . ژنوم این افراد تفاوتهای ظاهری و رفتاری آنها را تعیین میکند. جالبتر از آن اینکه هریک از این افراد حامل تقریباً یک نیم دو جین ژن ناقص هستند که به احتمال زیاد بی خبر از آن میباشند، مگر اینکه اقوام نزدیک آنها از میان میلیونها انسانی باشد که مبتلا به بیماری ژنتیکی هستند. ژن درمانی پروسهای است که میتواند سبب درمان بسیاری از این اختلالات و بیماریهای شود.
ژن درمانی چیست؟
ژن درمانی یک تکنیک تجربی برای پیشگیری و درمان بیماری به کمک ژنها میباشد. به کمک این تکنیک پزشکان قادر خواهند بود بدون استفاده از جراحی یا داروها، تنها با وارد کردن یک ژن به سلولهای بدن بیمار، او را درمان کنند. محققان رویرکردهای متعددی را برای ژن درمانی استفاده میکنند؛ از جمله:
- جایگزین کردن ژن جهش یافته با کپی سالمی از همان ژن.
- غیرفعال کردن یا خاموش کردن ژن جهش یافتهای که عملکرد نادرستی دارد.
- وارد کردن ژن جدید به سلولها برای مبارزه با یک بیماری.
مهمترین چالش ژن درمانی انتقال ژنهایی است که عملکرد صحیح و درازمدتی داشته باشند. این ژن باید به درون سلولهای هدف منتقل شده و بدون ایجاد عوارض جانبی، به درستی عمل کند.
برای اولین بار در اوایل سال ۱۹۷۰ دانشمندان موضوعی با نام جراحی ژن را برای درمان بیماریهای ناشی از نقص ژنی مطرح کردند. اولین بیماری که برای درمان از طریق ژن درمانی پیشنهاد شد یک اختلال عصبی نادر به نام سندرم لِش نیهان (Lesch-Nyhan) بود. دانشمندان آزمایشی را انجام دادند که در آن یک ژن بیان کننده آنزیم برای اصلاح این اختلال به درون گروهی از سلولها تزریق میشد، تئوری دانشمندان این بود که در قدم بعدی میتوان این گروه از سلولها را به بیماران مبتلا به سندرم لِش نیهان تزریق کرد.
همزمان با پیشرفت علم ژنتیک در سالهای ۱۹۸۰، ژن درمانی به عنوان یک روش درمانی مادامالعمر جایگاه ویژهای در ذهن دانشمندان پیدا کرد؛ اگرچه روشهای درمانی مطرح شده تنها در سطح تئوری بود. یکی از محرکهای اصلی پیشرفت ژن درمانی شناسایی ژنهای ناهنجاری بود که سبب بیماریهای ژنتیکی میشدند. با شناسایی ریشهی ژنتیکی بیماریهایی مانند سرطان روده، شیدایی، آلزایمر، بیماریهای قلبی، دیابت و …، که اعضای یک خانواده را در طول نسلها درگیر میکرد، انگیزه برای ژن درمانی افزایش یافت.
اگرچه ژنها تنها دلیل اصلی ابتلا به همهی بیماریها نیستند اما درکنار فاکتورهای محیطی مانند سیگار، آلودگی و استرس، شخص را برای ابتلا به بیماری مستعدتر میکنند. درواقع بسیاری از دانشمندان باور دارند که تمامی بیماریها یک جزء ژنتیکی دارند.
اولین شخصی که تحت ژن درمانی قرار گرفت دختر بچهی ۴ سالهای بود که از نقص آدنوزین دآمیناز (ADA) رنج میبرد. این بیماری سیستم ایمنی را تضعیف کرده و شخص را مستعد عفونتهای خطرناکی میکند. محققان ژنها تولید کننده ADA را وارد گلبولهای سفید کرده و سپس این سلولها را به بدن بیمار بازگرداندند. آزمایش موفقیتآمیز بود و تولید ADA در بدن بیمار افزایش یافت؛ اما به دلیل اینکه بیمار به همراه ژن درمانی داروهای دیگری را نیز مصرف میکرد، شک و شبههایی درمورد تاثیر ژن درمانی وجود داشت.
با انجام آزمایشهای بالینی بیشتر، عصر جدیدی در ژن درمانی آغاز شد. این آزمایشها زمینههای جدیدی را برای ژن درمانی فراهم کرد، از جمله ژن درمانی برای بیماری سیستیک فیبروزیس، بیماری که بر مجاری تنفسی اثر میگذارد. استفاده از ژن درمانی برای بیماران مبتلا به سرطان مغز کاربرد دیگری بود که مطرح شد، در این رویکرد ژنهایی که برای افزایش تاثیرپذیری سلولهای سرطانی به داروها طراحی شده بود، به سلولها تزریق میشد. به علاوه ژن درمانی برای بیمارانی که دچار تصلب شرایین هستند نیز درحال بررسی است، در این رویکرد رشد رگهای خونی جدید در نزدیکی رگ مسدود شده القا میشود.
اگرچه ژن درمانی روش درمانی امیدبخشی برای بیماریهای متعددی از جمله بیماریهای ژنتیکی، سرطان و برخی انواع عفوتهای ویروسی میباشد؛ اما همچنان یک تکنیک خطرناک بوده و برای اطمینان از ایمنی و اثرگذاری بهتر، تحت مطالعه میباشد. ژن درمانی در عمل یک فرایند درازمدت است بنابراین بسیاری از آزمایشگاههای آکادمی و تجاری به سختی در این زمینه کار میکنند. درحال حاضر ژن درمانی تنها برای بیماریهایی استفاده میشود که هیچ درمان دیگری ندارند.
ژن درمانی در گذر زمان
- ۱۹۸۵
دکتر W. French Anderson و دکتر Michael Blaese نشان دادند که سلولها بیماران مبتلا به نقص آدنوزین دِآمیناز (ADA) میتواند از طریق کشت بافت در آزمایشگاه اصلاح شود. آنها از رتروویروسها برای انتقال ژن سالم ADA به سلولها استفاده کردند.
دکتر Anderson، دکتر Blaese و دکتر Culver به همراه بیماران ژندرمانی
- ۱۹۸۶
دانشمندان با انتقال ژنهای سالم به سلولهای مغز استخوان حیوانات، ایمنی و اثرگذاری آنها را آزمایش کردند. پروسه بی خطر بود اما تعداد سلولهایی که ژن سالم را دریافت کرده بودند به اندازهای کم بود که برای استفادهی درمانی مناسب نبود.
- ۱۹۸۸
محققان تصمیم گرفتند به جای سلولهای مغز استخوان از گلبولهای سفید (سلولهای T) استفاده کنند. این تغییر استراتژی تعداد ژنهای سالم دریافت شده را افزایش داد، آزمایش تا اندازهای موفق بود که تیم تصمیم گرفت در قدم بعدی راهی برای انتقال ژن به انسانها پیدا کنند.
گلبولهای سفید(Courtesy of Dr. Kenneth Culver, Novarti Pharmaceuticals Corporation)
- ۱۹۸۹
تیم برای آزمایش ایمنی و اثرگذاری پروسه ژن درمانی در بیماران سرطانی، با دکتر Steven Rosenberg همکاری کرد. به کمک بیماران مبتلا به سرطانِ ملانوما بدخیم، لنفوسیتهای نفوذکننده به تومور (سلولهای TIL) را طراحی و سپس ویروسی برای انتقال مارکر DNA به این سلولها مهندسی شد. به کمک این سلولهای TIL نشاندار محققان دریافتند کدام سلولها بهترین عملکرد را برای درمان سرطان دارند و اینکه ویروسهای مهندسی شده برای استفاده در سلولهای انسانی ایمن هستند.
- ۱۹۹۰
دکتر Anderson، دکتر Blaese و دکتر Culver از ویروسها برای انتقال ژن ADA سالم به دختر بچههای ۴ ساله و نه سالهی مبتلا به نقص ADA استفاده کردند. هر یک از بیماران در طی دو سال، به طور مکرر درمان را دریافت کردند. این آزمایش به عنوان یک موفقیت تلقی شد، اما بیماران به موازات از طریق آنزیم جایگزین استاندارد با استفاده از پلی اتیلن گلیکول (PEG)- ADA نیز درمان شده بودند. بیمار نه ساله نقاشیهایی را از روند درمانیاش رسم کرده است، در این نقاشی او درحال دریافت سلولهای اصلاح شدهی خود است.
(Courtesy of the National Museum of American History)
- ۱۹۹۳
محققان از ژندرمانی برای درمان نوزادان مبتلا به نقص ADA استفاده کردند. ژنهای ADA نرمال و سالم، به سلولهای خونی نابالغ ایزوله شده از بند ناف نوزادان منتقل شدند؛ به امید اینکه این سلولها مزایای طولانی مدتی خواهند داشت.
- ۱۹۹۹
در سپتامبر سال ۱۹۹۹ یکی از بیمارانی که در یک آزمایش بالینی ژن درمانی برای نقص اورنیتین ترانس کاربامیلاز (OCT)، ذرات آدنوویروسی نوترکیب را از طریق تزریق درون کبدی دریافت کرده بود، درگذشت. پاسخ ایمنی گسترده بدن او به ذرات آدنوویروس به ناتوانی در چند اندام منجر شد.
- ۲۰۰۰
اولین موفقیت بدون ابهام در ژن درمانی رای درمان نوعی نقص ایمنی شدید توام (SCID) در این سال رخ داد. اما به دلیل فعالسازی ژنهای تومورزا، چند کودک درمان شده به سرطان خون مبتلا شدند که منجر به مرگ یکی از آنها شد.
- ۲۰۰۲
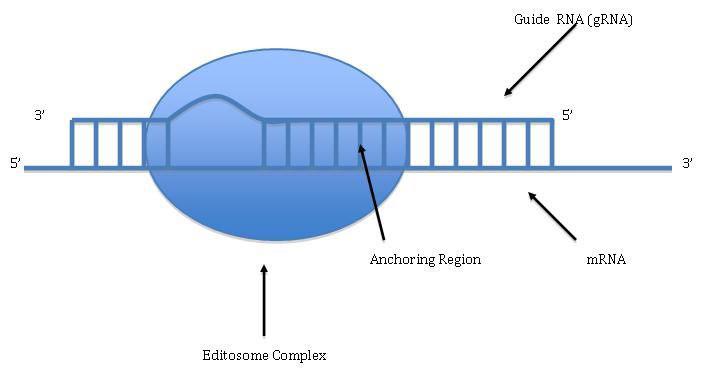
درمان کم خونی داسی شکل در موشها و کشف رویکرد درمانی جدید برای اصلاح خطاهای mRNA که این تکنیک برای درمان تالاسمی، سیستیک فیبروزیس و برخی سرطانها کارساز است.
- ۲۰۰۶- ۲۰۰۹
ژن درمانی موفقیتآمیز برای نقص در ADA.
اولین گزارش ژندرمانی موفق برای یک اختلال در سیستم عصبی مرکزی.
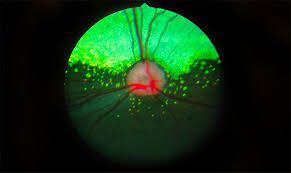
ژن درمانی موفق برای نوعی نابینایی مادرزادی (بیماری لبر) که بهبود در بینایی بعد از یک سال نیز ادامه داشت.
- ۲۰۱۰
درمان کور رنگی در سگها از طریق هدف قرار دادن گیرندههای نوری مخروطی.
درمان موفقیتآمیز تالاسمی ماژور از طریق وارد کردن ژن بتا گلوبین به سلولهای خونی و مغز استخوان.
درمان کور رنگی در سگها
- ۲۰۱۳
سه بیمار از پنج بیماری که برای درمان لوسمی حاد لنفاوی به مدت ۵ ماه تا ۲ سال سلولهای T تغییریافته دریافت کرده بودند، بهبود یافتند. یکی از بیمارن در اثر عود بیماری و بیمار دیگر در اثر لخته خون غیرمرتبط با بیماری درگذشتند.
- ۲۰۱۵
محققان ژن نوترکیبِ بیان کننده نوعی آنتیبادی را به موشها منتقل کردند، تولید این آنتیبادیها در بدن موش ویروس HIV را از بین برد. آزمایشهای مشابهی برای درمان ابولا، آنفولانزا، مالاریا و هپاتیت، روی حیوانات درحال انجام است.
گروهی از دانشمندان از جمله کاشف کریسپر، جنیفر دودنا، برای استفاده از ژن درمانی در سلولهای جنینی درخواست مهلت قانونی کردند تا قبل از بررسی کامل توسط دانشمندان و موسسسات دولتی هیچ اقدامی در این زمینه صورت نگیرد.
- ۲۰۱۶
درمان نقص ADA و سیستم ایمنی ناکارآمد از طریق ژن درمانی به طور رسمی در اروپا پذیرفته شد.
دانشمندان چینی آزمایشهایی را برای درمان سرطان ریه از طریق تغییر سلولهای T به کمک تکنیک کریسپر، آغار کردند.
- ۲۰۱۷
درمان لوسمی حاد لنفاوی و لنفوم غیر هوچکینی از طریق ژن درمانی، در FDA پذیرفته شد. در دسامبر همین سال FDA استفاده از ژن درمانی برای درمان بیماری مادرزادی لبر را نیز تایید کرد.