برای ویرایش ژنوم میتوکندری نوعی سم باکتریایی یافت شده است که اجازه می دهد، DNA در یک ارگانل سلولی به نام میتوکندری به طور دقیق تغییر یابد. این پیشرفت می تواند به مبارزه علیه جهش های صورت گرفته در DNA میتوکندری کمک کند.
جهش در DNA میتوکندری
DNA در یک اندامک سلولی به نام میتوکندری فقط ۱۳ پروتئین را رمزگذاری می کند که همه آن ها در تولید منبع انرژی سلول نقش دارند. جهش در DNA میتوکندری (mtDNA) می تواند طیف وسیعی از بیماری های متابولیکی علاج ناپذیر در زندگی انسان را ایجاد کند. توسعه روش های ویرایش mtDNA جزو اهداف طولانی مدت در ژنتیک میتوکندری بوده است. موک و همکارانش طی گزارشی در Nature، یک روش مولکولی را گزارش می دهند که برای اولین بار، ویرایش دقیق mtDNA را امکان پذیر می کند.
نکته اصلی این دستاورد کشف سمی است که توسط باکتری ها علیه باکتری های همسایه خود برای ازبین بردن آن ها ترشح می کنند.
آنزیم سایتیدین دآمیناز-DddA- چیست؟
سم باکتریایی کشف شده توسط موک و همکاران، حاوی آنزیمی به نام سایتیدین دامیناز به نام DddA است که کاتالیزور تبدیل سیتوزین پایه نوکلئوتیدی سیتوزین به نوکلئوتید دیگر، اوراسیل است.
ویژگی آنزیم سایتیدین دآمیناز
یکی از ویژگی های قابل توجه DddA این است که DNA دو رشته ای را هدف قرار می دهد، در حالی که همه deaminases3 سایتیدین قبلاً شناسایی شده DNA تک رشته ای را هدف قرار می دهند. اگرچه رویکردهای ویرایش ژنوم معمولی شامل آنزیم های نوکلئاز هستند که به عنوان قیچی مولکولی برای برش DNA در هر دو رشته عمل می کنند؛اما DddA سیتوزین را را بدون شکستن دو رشتهDNA به یوراسیل تبدیل می کند. این امر به ویژه در ویرایش ژنوم میتوکندری مهم می باشد، که فاقد سازوکارهای کارآمد برای ترمیم دی ان ای DNA دو رشته ای است.
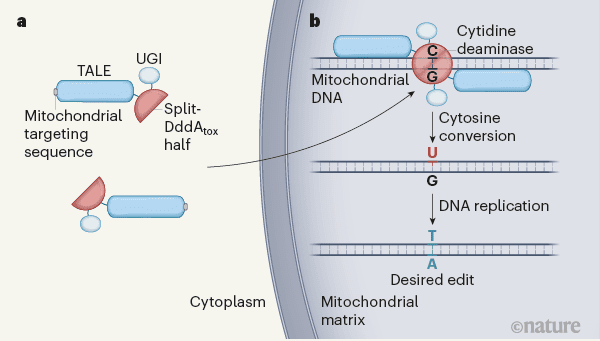
محققان برای ویرایش ژنوم میتوکندری مجبور بودند چندین چالش را پشت سر بگذارند. مهمترین واقعیت این است که سایتیدین دامیناز برای سلول های پستانداران سمی است؛ بنابر این موک و همکاران دمین سم DddA را به دو قسمت غیرفعال split-DddAtox تقسیم کردند. آن ها این نیمه ها را به پروتئین های TALE متصل کردند، که می توانند برای اتصال به توالی DNA مشخص شده ساخته شوند. اتصال TALE به mtDNA باعث می شود که تقسیم DddAtox به نصف برسد و فعال شود.
چرا تکنیک CRISPR روی mtDNA موثر نیست؟
برای رسیدن به mtDNA در ماتریکس میتوکندری، TALE-split-DddAtox باید از دو غشای میتوکندری عبور کند. بنابراین مک و همکارانش سازه را با یک توالی آمینه اسید نشانه گذاری کردند که به عنوان یک سیگنال هدفمند ژنوم میتوکندری عمل می کند. توانایی بهره برداری ازکمپلکس پروتئینی موجود به این روش یک مزیت مهم در مقایسه با سیستم های RNA هدایت شده برای ویرایش ژنوم مانند CRISPR-Cas9 می دهد. روش های CRISPR روی mtDNA عملکرد مفیدی ندارند، احتمالاً به دلیل آنکه سلول، مکانیسمی برای وارد کردن RNA به میتوکندری ندارد.
چالش دیگر این است که د آمیناز سایتیدین، سیتوزین را به یوراسیل تبدیل می کند، نه اینکه به نوکلئوتید تیمین اختصاصی DNA تبدیل کند. اگرچه یوراسیل دارای همان خصوصیات جفت شدن پایه مانند تیمین است؛ اما متعلق به RNA است. این پایه به طور معمول از طریق DNA به کمک آنزیمی به نام گلیکوزیلاز uracil-DNA بریده می شود و با سیتوزین جایگزین می شود.
روش آزمایش
موک و همکاران نیمی از TALE-split-DddAtox را با یک مهارکننده گلیکوزیلاز اوراسیل (UGI) به کار بردند. این ماده، یوراسیل را از اثر گلیکوزیلاز محافظت می کند تا مرحله بعدی تکثیر یا ترمیم DNA انجام شود ، در این مرحله پایه گوانین (G) از رشته مکمل (- که قبل از ویرایش با C جفت شده بود-) توسط آدنین جایگزین شده است. ادغام UGI بهره برداری از ویرایش نوکلئوتید سیتوزین را در حدود هشت برابر افزایشداده است.
ساختار نهایی ویرایشگرDddA- پایه سیتوزین مشتق شده از DdCBE، شامل سیگنال هدفمند میتوکندری، پروتئین TALE، نیمه تقسیم DddAtox و یک UGI است (شکل ۱). موک و همکاران نشان داد که این سازه به طور موثری در میتوکندری سلول های انسانی وارد می شود و می تواند به صورت انتخابی ژن های میتوکندری را اصلاح کند. ویرایش از یک جفت نوکلئوتید C-G تا T-A، در حدود ۵-۵۰٪ از زمان رخ داده است. بازده ویرایش توسط عوامل مختلفی تحت تأثیر قرار گرفت: فاصله بین دو زیر واحد DdCBE، طراحی TALE، جهت گیری نیمه تقسیم DddAtox و موقعیت سیتوزین هدف نسبت به منطقه های اتصال TALEمی باشد.
آیا ویرایش ژنوم اختصاصی می باشد؟
نکته مهم در مورد کلیه ابزارها و روش های ویرایش ژنوم این است که آیا آن ها DNA را در مناطق ناخواسته اصلاح می کنند. مک و همکارانش سلول های تحت درمان و درمان نشده را با یکدیگر مقایسه کردند و هیچ اثر خارج از هدف در ژنوم هسته ای پیدا نکردند. فعالیت خارج از هدف در mtDNA کم بود، به جز در مورد یک ژن، که در آن ویرایش های خارج از هدف با طرح TALE مرتبط بودند.
مك و همكاران پتانسیل درمانی DdCBE را مورد بررسی قرار دادند. نویسندگان گزارش دادند كه ویرایش سیتوزین توانایی اصلاح ۴۹٪ جهش های مضر شناخته شده mtDNA را دارد. با این حال در شکل فعلی، DdCBE می تواند به طور مؤثر فقط پایه های C را که در ژنوم توسط یک T پیشرو هستند، ویرایش کند و دمین آن را باریک کند.
ارتباط بین DdCBE و DNA چگونه است؟
اتکاء DdCBE به تکثیر DNA برای اجرای تبدیل C-G به T-A به معنی حداکثر کارایی ویرایش نظری ۵۰٪ است. برای توضیح دو mtDNA که به تازگی تکثیر می شوند، هر یک از رشته های والدین DNA دریافت می کنند؛ یکی از آن ها بدون استفاده ، حاوی گوانین است که با یک سیتوزین جفت می شود. با این حال، موک و همکاران دریافتند که فعالیت DdCBE در طی چند روز ادامه دارد، به طور بالقوه فرصتی برای ویرایش بیشتر در طول رویدادهای تکرار بعدی ایجاد می کند. این که آیا اثرات خارج از هدف در طول قرار گرفتن در معرض طولانی مدت با DdCBE افزایش می یابد یا خیر؟ یک نکته قابل توجهی برای آینده خواهد بود.
این احتیاط ها به این معنی است که DdCBE ممکن است باعث کاهش جهش mtDNA به جای حذف کامل شود. اما با توجه به اینکه شدت علائم بیماری های mtDNA با بار جهش افزایش می یابد، توانایی کاهش سطح جهش به خودی خود نوعی درمان محسوب می شود.
هسته های هدفمند میتوکندری قبلاً برای از بین بردن جهش های خاص mtDNA در موش مورد استفاده قرار گرفته اند. دو رشته ی تشکیل شده از طریق شکستن، منجر به تخریب mtDNA می شود. سلول ها حاوی نسخه های زیادی از mtDNA آن ها هستند و فقط نسخه هایی که دارای جهش مضر هستند تخریب می شوند. اما این خطر وجود دارد که در موارد بار جهش زیاد، از بین بردن mtDNA جهش یافته می تواند تعداد کپی mtDNA را به سطوح کم خطر برساند. اگر همه نسخه های mtDNA دارای جهش یکسان باشند، از روش هسته ای استفاده نمی شود. در مقابل، ویرایش نوکلئوتید می تواند کسری از mtDNA که حامل جهش است را کاهش دهد بدون این که تعداد نسخه را کاهش دهد. بنابراین ممکن است وقتی بار جهش زیاد باشد گزینه مورد نظر (یا تنها) باشد.
آیا DdCBE پتانسیل جلوگیری از انتقال بیماری mtDNA را دارد؟
MtDNA به طور معمول فقط از مادران به ارث می رسد. سزارین سبب جایگزینی میتوکندری فعلی انتقال جهش mtDNA را با پیوند ژنوم هسته ای از تخم مادر که حامل mtDNA جهش یافته، کاهش می دهد. ویرایش نوکلئوتید برای کاهش بار جهش در تخم ها یا جنین های اولیه می تواند از نظر تئوری یک روش جایگزین باشد. با این حال، تصور می شود که تکثیر mtDNA در پنج تا شش روز اول توسعه انسانی رخ نمی دهد، بنابراین موفقیت ممکن است به حمایت طولانی مدت از یوراسیل وابسته باشد.
کار موک و همکارانش یک پیشرفت اساسی در جهت توسعه ژن های درمانی برای بیماری های mtDNA است. علاوه بر این، با استفاده از ابزار برای تغییر تجربی ژنوم میتوکندری، اکنون می توانیم درک بهتری از ارتباط جهش mtDNA در بیماری های پیچیده، همانند سرطان و اختلال عملکرد سلولی مرتبط با سن بدست آوریم. این مطالعه همچنین به احتمال زیاد الهام بخش تحولات بیشتر در مهندسی پروتئین و تکامل است که دامنه و کارآیی DdCBE را افزایش می دهد و به جستجوی سایر ویرایشگر می پردازد.
