Real-time PCR که Quantitative PCR نیز نامیده میشود، تکنیکی است که به طور گسترده در بررسیهای کمی بیان ژن به کار میرود. Real-time PCR همچنین روشی بسیار قدرتمند و حساس در تعیین تعداد ویروسهای موجود در یک نمونه است. ویژگی کلیدی Real-time PCR، فراهم شدن امکان بررسی تکثیر قطعات DNA همزمان با انجام گرفتن آزمایش و با استفاده از گزارشگرهای فلوئورسنت (fluorescent reporters) میباشد. قدرت سیگنال فلوئورسنت تولیدشده ارتباط مستقیمی با مقدار مولکولهای تکثیرشده دارد. این تکنیک در تستهای مختلف تشخیصی، جای PCR عادی را گرفته است.
آزمایش PCR از زمان معرفیاش تاکنون، کاربردهای گستردهای در زمینههای مختلف مانند کلون کردن ژن، نقشهبرداری ژنی، تشخیص جهشها، توالییابی DNA و تعیین هویت افراد داشتهاست. آزمایش PCR همچنین میتواند در سنجش میزان بیان ژنها مورد استفاده قرار گیرد و مثالی برای این کاربرد تکنیک Competitive PCR است. این تکینک از جمله روشهایی است که برای سنجش میزان mRNA تولیدشده در حین رونویسی یک ژن خاص به کار میرود. محصولات تولیدشده طی Competitive PCR در پایان فرایند و طی الکتروفورز و یا densitometry بررسی میشوند و حین انجام واکنش امکان آنالیز آنها وجود ندارد. این به آن معنی است که مشاهده نتایج تنها پس از کامل شدن واکنش و انجام یک سری فرایندهای دیگر ممکن خواهد شد.
در روش Real-time PCR نیاز به این دستکاریها برطرف شده است و همین موضوع از مزیتهای این تکنیک است و خطر آلودگی را کاهش میدهد. همچنین از دیگر مزایای استفاده از آزمایش Real-time PCR به منظور سنجش میزان بیان ژنها، حساسیت آن است؛ به این معنی که میتواند حتی یک کپی از رونوشت موردنظر را تشخیص دهد.
ایجاد فناوریها و نوآوریهای جدید در زمینه تجهیزات و نیز رنگهای فلوئوروسنت و وسایل تشخیص آنها باعث شد که روشهای Real-time PCR توسعه پیدا کنند، که میتوانند محصولات PCR را حین تولید در چرخههای متوالی، به صورت real-time تشخیص دهند. این تکنیکها همچنین امکان بررسی چندین ژن به صورت همزمان را فراهم میکنند. اما استفاده از آنها مشکلاتی نیز به همراه دارد؛ از جمله این که راهاندازی آنها سختتر از PCR استاندارد است.
انواع مختلفی از Quantitative PCR وجود دارد که نوع مورد استفاده بسته به هدف ما از انجام آزمایش میباشد. دو حالت کلی وجود دارد: ۱- اگر هدف ما تنها تشخیص یک ژن و نه اندازهگیری میزان بیان آن باشد، از Q-PCR پایه (Real-time) استفاده خواهیم کرد. در این حالت، از دادههایی که حین واکنش تولید میشوند استفاده میکنیم تا میزان محصولات تولیدشده را با گذشت زمان و حین انجام آزمایش بسنجیم. ۲- اگر هدف، سنجش میزان بیان یک ژن خاص باشد، Real-time RT-PCR مورد استفاده قرار خواهد گرفت. به این صورت که مجبوریم پیش از آغاز فرایند Quantitative PCR، استخراج RNA و تبدیل آن به cDNA را انجام دهیم. اساس این تکنیک، ارتباط مقدار RNA رونویسی شده به میزان بیان ژن موردنظر است و میتوان با استفاده از آن میزان بیان ژنها را در شرایط مختلف مقایسه کرد.
مقاله مرتبط: PCR چیست؟
روشهای انجام Real-time PCR
تکنیک Quantitative PCR امکان پیبردن به مقدار نوکلئیک اسید اولیه موجود در نمونه را برای ما فراهم میکند. مقدار محصولی که پس از طیشدن تعداد چرخههای مشخصی از PCR تولید میشود، بستگی به میزان نوکلئیکاسید اولیه دارد. اگر در آغاز PCR، مقدار این مولکولها کم باشد، محصول کمی تولید خواهد شد و برعکس اگر مولکولهای آغازکننده واکنش زیاد باشند، مقدار محصولات نیز زیاد خواهد بود. این موضوع، اساس تعیین مقدار مولکولهای اولیه حاضر در عصاره سلولی را تشکیل میدهد.

در Quantitative PCR، میزان محصولاتی که حین یک آزمایش PCR تولید میشوند با میزان محصولات تولیدشده طی آزمایشهای PCRی با مقدار نوکلئیکاسید آغازکننده مشخص، مقایسه میشود. در روشهای اولیه Quantitative PCR، الکتروفورز در ژل آگارز به منظور انجام چنین مقایسههایی به کار میرفت. پس از رنگآمیزی ژل، شدت رنگ نوارهای از پیش تعیینشده با شدت رنگ نوار آزمایش مقایسه میشد تا بیشترین شباهت تعیین شود و از روی آن میزان نوکلئیک اسید اولیه نمونه مورد آزمایش به دست آید. این فرایند علیرغم آسان و انجام پذیرتر بودن، دارای دقت کمی است. این موضوع از آنجا ناشی میشود که وجود تفاوتهای قابلتوجه در میزان نوکلئیکاسید اولیه خود را به صورت تفاوتهایی اندک در شدت رنگ نوار محصولات در الکتروفورز نشان میدهند.
دو روش کلی برای انجام Real-time PCR معرفی شده است:
- میتوان به مخلوط PCR رنگی را افزود که با اتصال به DNA دورشتهای سیگنال فلوئوروسنت ایجاد میکند. این رنگ SYBR green نام دارد و استفاده از آن ارزانتر و سادهتر است. این تکنیک میزان کل DNAهای دورشتهای موجود را حین انجام PCR و در هر زمانی گزارش میدهد. در طول هر چرخه Real-time PCR میزان سیگنال فلوئوروسنت با افزایش بیشتر و بیشتر DNAهای دورشتهای که به SYBR green متصل میشوند، افزایش پیدا میکند. البته ممکن است مقدار گزارشداده شده بیشتر از مقدار واقعی باشد. علت این موضوع اتصال غیراختصاصی پرایمرها به همدیگر و تولید دایمر پرایمر، تولید محصولات غیراختصاصی و درنتیجه افزایش یافتن مقدار DNAهای دورشته ای است.
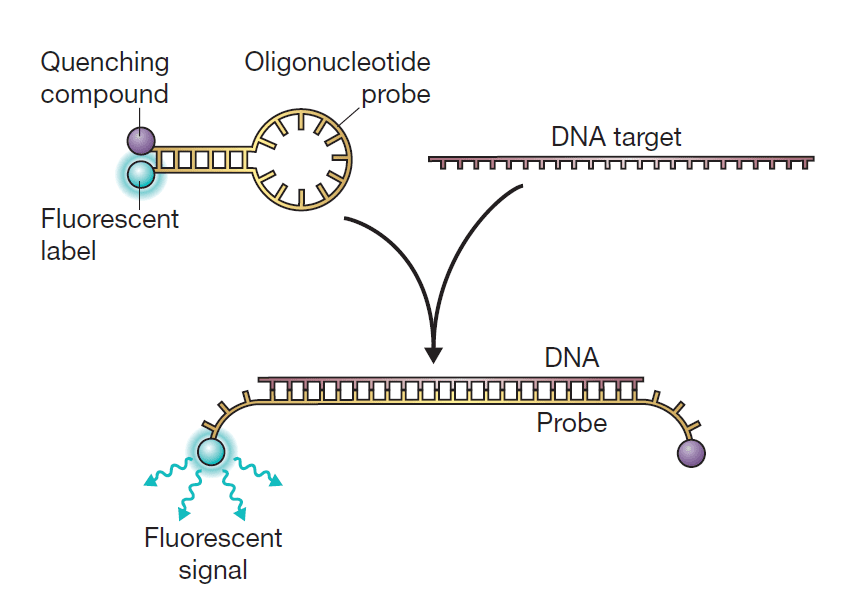
- تکنیک دیگر استفاده از پروب گزارشگری (reporter probe) است که با اتصال به محصولات PCR سیگنال فلوئوروسنت ایجاد میکند و استفاده از آن معمولتر است. این تکنیک به Taq Man 5’ nuclease assay معروف است. پروب به کار رفته در این فرایند از آن جهت reporter نامیده شده که نشانگر وجود محصول موردنظر است. محل اتصال پروب، به رشته الگو و نزدیک به پرایمرهای اصلی PCR و پایینتر از آن است. این متد کمتر در معرض خطاهایی قرار دارد که از اتصالات نادرست از جمله دایمرهای پرایمر حاصل میشود. در این حالت هر مولکول پروب متشکل از یک الیگونوکلئوتید و دو لیبل است. رنگ فلوئوروسنت به انتهای ۵’ رشته الیگونوکلئوتیدی و ترکیب quencher به انتهای دیگر رشته متصل میشود. این ترکیب وظیفه مهار سیگنال فلوئوروسنت را بر عهده دارد و این کار را با جذب انرژی از رنگ فلوئوروسنت انجام میدهد. این پدیده FRET (Fluorescence Resonance Energy Transfer) نام دارد. در حالت عادی سیگنال فلوئوروسنتی ایجاد نمیشود؛ چون الیگونوکلئوتید به گونهای طراحی شده است که دو انتهای آن با همدیگر مکمل شده و رنگ فلوئوروسنت و ترکیب quencher در کنار همدیگر قرار میگیرند. هیبریداسیون بین الیگونوکلئوتید و محصول PCR، اتصال بین دوسر الیگونوکلئوتید را بر هم میزند و این کار باعث ایجاد سیگنال فلوئوروسنت میگردد. در حین انجامشدن PCR، پلیمراز Taq، با رسیدن به پروب با خاصیت اگزونوکلئازی ۳’ به ۵’ خود آن را تجزیه میکند و با این کار رنگ و ترکیب quencher در محیط آزاد میگردند. هر چه محصولات تولیدشده بیشتر باشند، پروبهای بیشتری به توالی مکمل خود در این محصولات متصل میشوند. هر چه تعداد پروب بیشتری متصل شود، سیگنال فلوئوروسنت بیشتری حین آزاد شدن رنگ از quencher ایجاد میگردد. درنتیجه ارتباطی میان سیگنالهای فلوئوروسنت ایجادشده در Real-time PCR و مقدار توالی الگو وجود دارد.
هر دو این روشها (استفاده از رنگ SYBR green و یا پروب Taq Man) امکان سنجش سیگنال فلوئورسنت را به دنبال تولید محصولات PCR فراهم میآورند. این تکینکها وسیله قابلاتکایی برای سنجش میزان اسیدنوکلئیکها و نیز تشخیص وجود و یا عدم وجود یک توالی خاص هستند. انواع مختلفی از سختافزارها برای انجام real time PCR وجود دارد و دستگاههای پرسرعت میتوانند یک آزمایش PCR را در مدت زمانی کمتر از ۳۰ دقیقه انجام دهند. Real-time PCR به سرعت به سمت اتوماسیون پیش رفته است، تا جایی که به بهترین روش انجام Quantitative PCR مبدل گشته است. تجهیزات اولیه انجام این فرایند بسیار گرانقیمت بودهاند، اما دستگاههای نسل دوم، با قیمتهای معقولتری به صورت تجاری در دسترس میباشند.
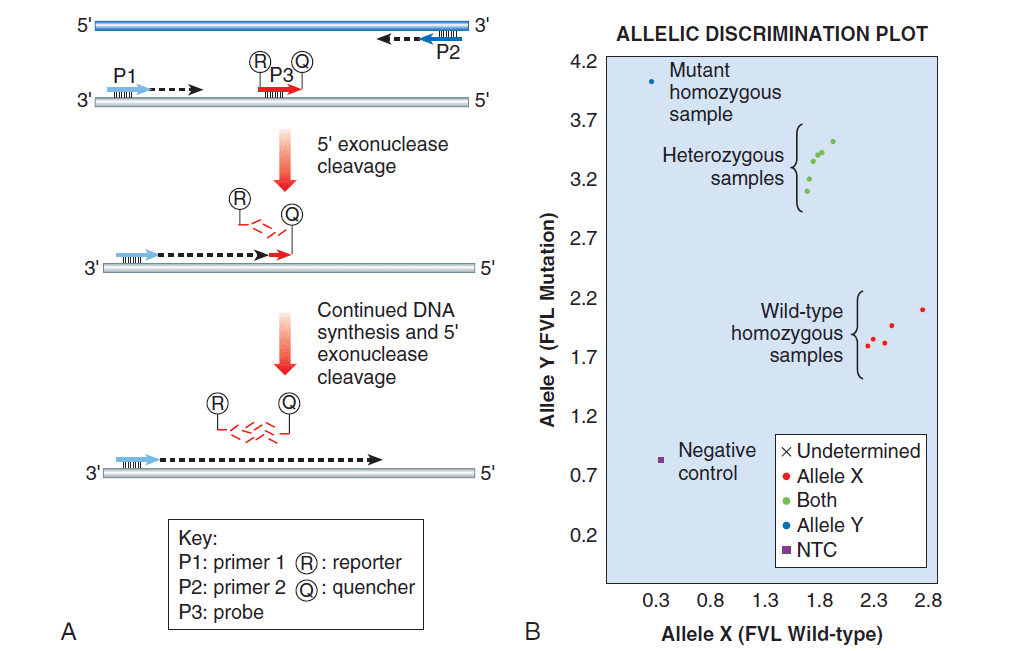
تکینکهای بسیاری برای تشخیص پروبهای الگونوکلئوتیدی وجود دارند و دستگاههای متعددی نیز برای انجام Real-time PCR ایجاد شدهاند. از جمله تفاوتهای این دستگاهها، مکانیسم چرخههای حرارتی و سیستمهای اپتیک است. Taq Man و Lightcycler از تکنولوژی فلوئورسانس برای تشخیص جهشها با مکانیسم تمایز آللی (allelic discrimination) بهره میگیرند. شکل زیر نشاندهنده انجام واکنش real time PCR برای تشخیص فاکتور V لیدن است.
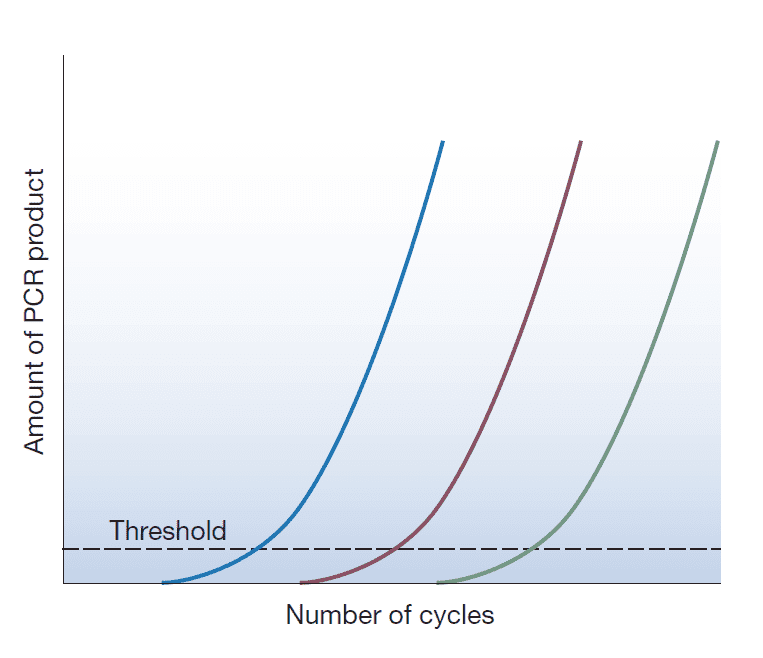
پس از انجام مراحل فوق، تعیین نتیجه آزمایش Real-time PCR نیازمند انجام مقایسه میان PCRهای تست و کنترل است. این مقایسه با مشخصنمودن مرحلهای صورت میگیرد که در آن میزان سیگنالهای فلوئوروسنت به آستانهای که از پیش تعیین شده است، برسد. هر چه آزمایش PCR مورد بررسی زودتر به این دامنه برسد، به آن معنی است که مقدار DNA موجود در مخلوط اولیه واکنش بیشتر است.
مراحل Real-time PCR
در یک آزمایش PCR توالی DNA هدف به صورت نمایی تکثیر میشود؛ به این صورت که یک الگو به دو، دو الگو به چهار و چهار الگو به هشت الگو تبدیل میشود و این روند ادامه پیدا میکند. در نگاه اول این موضوع درست به نظر میرسد. با اینحال، تکثیر نمایی نمیتواند تا ابد ادامه یابد و معمولا تا چرخه ۳۵ام سرعت واکنش کاهش خواهد یافت. در این حالت، پرایمرها و dNTPها مثل قبل به مقدار زیاد وجود ندارند؛ از بازده DNA پلیمراز کاسته شده است؛ دناتورهشدن DNAها به صورت کامل انجام نمیگیرد؛ و محصولات واکنش توسط خاصیت نوکلئازی پلیمراز از بین میروند. با وقوع موارد گفتهشده، واکنش وارد یک فاز خطی میشود. در این حالت مانند فاز لگاریتمی توالیهای الگو به طور کامل دو برابر نمیشوند. تا اینکه درنهایت تا چرخه ۴۰ام، واکنش وارد مرحله کفه (plateau) میشود که توقف تکثیر اتفاق میافتد.
پس واکنش PCR قابل تقسیم به چهار فاز کلی است: فاز اولیه، linear ground phase نام دارد. در این مرحله PCR به تازگی شروع شده است و سیگنال حاصل از سیگنال پسزمینه فراتر نرفته است. فاز دوم، exponential phase است و طی آن سیگنال فلئورسنت به طرز قابل توجهی از سیگنال پسزمینه بیشتر میشود. در این شرایط PCR در بهینهترین شرایط ممکن است و محصولات در هر چرخه دو برابر میشوند. فاز سوم Linear phase نام دارد و فاز چهارم نیز، plateau است که در آن سوبستراها کاهش مییابند و یا تخریب میشوند، آنزیم پلیمراز کارایی خود را از دست میدهد و شدت سیگنال فلوئورسنت دیگر افزایش نمییابد.
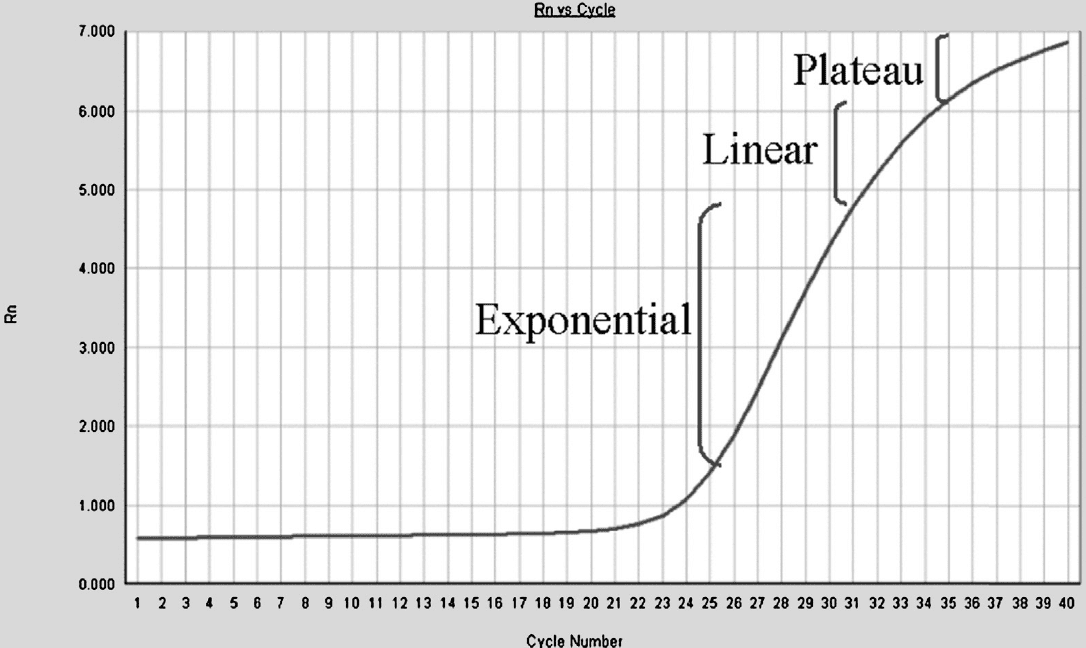
Real-time PCR وابسته به توانایی دستگاه در تشخیص حداقل تعداد چرخههایی است که پس از انجامشدنشان، میزان محصولات و درنتیجه سیگنال تولیدشده به حدی باشد که بتواند از noise فلوئورسنت زمینهای دستگاه فراتر رود. این سیگنالها در محدوده تشخیص دستگاه بوده و در چرخههای اولیه متغیر هستند.
شماره چرخهای از PCR که در آن سیگنال واقعی از noise پسزمینه تشخیص داده میشود، cycle threshold و یا CT نامیده میشود. واضح است که در PCR درصورتی که شرایط برابر بوده و هیچگونه مهاری وجود نداشته باشد و تجهیزات سالم باشند، هر چه میزان نوکلئیکاسید اولیه بیشتر باشد، میزان محصولات و سرعت تشخیص آنها نیز بالاتر خواهد بود. این موضوع در مورد Real-time PCR نیز صادق است. هرچه میزان الگوهای آغازگر بیشتر باشند، سریعتر به آستانه خواهیم رسید و CT نیز کمتر خواهد شد.
این موضوع اساس سنجش مقدار DNA است. در یک واکنش Real-time PCR با بازده ۱۰۰٪ میزان محصولات در هر چرخه دو برابر میشود. به طرز مشابهی هر یک عدد تغییر در CT (از CT بیشتر به سمت CT کمتر؛ به عبارت دیگر هر یک عدد کاهش در تعداد چرخههای موردنیاز برای رسیدن به آستانه) نشاندهنده دو برابر بودن تعداد مولکولهای هدف در آغاز واکنش است. ۲ عدد کاهش نیز نشاندهنده ۴ برابر بودن تعداد مولکولهای آغازگر است. بر این اساس میتوان رابطه مقابل را نوشت: Δ CT= ۲-ΔCT fold differences
مقدار CT به صورت خودکار توسط نرمافزار دستگاه Real-time PCR تعیین میشود، اما میتواند به صورت دستی و با تعیین خط آستانه توسط اپراتور انجام گیرد. خط آستانه چه به صورت دستی رسم شود و چه به صورت اتوماتیک، محل برخوردش با منحنی تکثیر در PCR مشخصکننده CT است. CT یا چرخه آستانهای باید در قسمت نمایی نمودار و جایی که مواد اولیه واکنش فراوان هستند، باشد.
Real-time RT-PCR
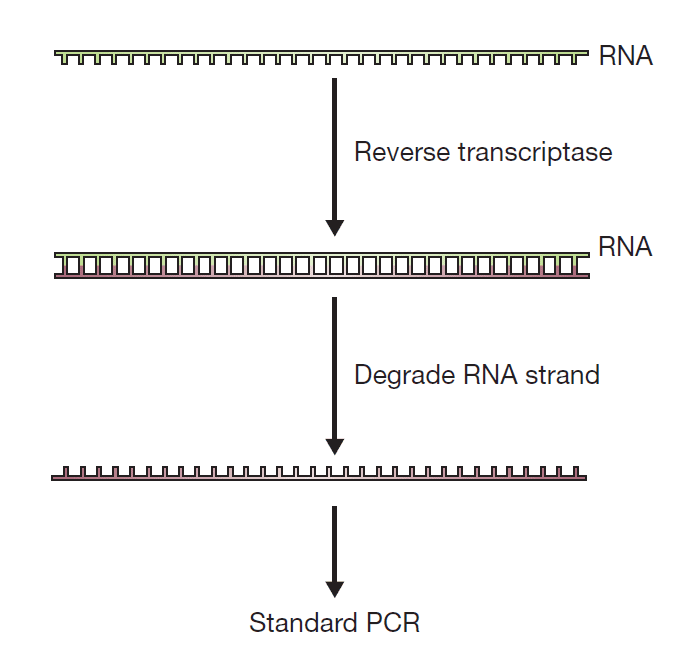
در صورتی که نمونه اولیه در Real-time PCR به جای DNA، RNA باشد، آزمایش چگونه انجام خواهد گرفت؟ پاسخ در RT-PCR است. نخستین گام در این فرایند تبدیل مولکولهای RNA به مولکولهای DNA تک رشتهای مکمل (cDNA) است. پس از انجام این فرایند مقدماتی، پرایمرهای PCR و پلیمرازهای Taq به مخلوط اضافه میشوند و واکنش دقیقا مطابق با PCR استاندارد پیش میرود. برخی از DNA پلیمرازهای مقاوم به حرارت دارای توانایی کپیبرداری از هر دو مولکول DNA و RNA هستند. به این معنی که دارای هردو نوع فعالیت رونوشتبرداری معکوس و DNA پلیمرازی مستقل از DNA هستند. استفاده از این آنزیمها امکان انجام این نوع از PCR را در طی یک واکنش واحد فراهم میکند.
کنترلهای Real-time PCR
واکنشهایی که برای سنجش تفاوتهای میان ژنها، انواع مختلف سلولها و درمانها استفاده می شوند، پتانسیل بالایی برای ایجاد نتایج متغیر (variability) دارند. این نتایج میتوانند ناشی ازخطا در پیپت کردن مواد واکنش و یا بازده و کارایی متفاوت PCR یا RT-PCR مورداستفاده باشد؛ و یا اینکه خطا از دستگاهی باشد که تغییرات شدت نور تولیدشده حین Real-time PCR را میسنجد. همچنین ناپایداری (instability) مواد اولیه مورد استفاده در آزمایش نیز میتوانند باعث حصول چنین نتایجی شوند. در نتیجه Real-time PCR، نیاز به استفاده گسترده از کنترلهایی دارد که به منظور راحتی کار پژوهشگران و متقاعد کردن آنان به درستی نتایج حاصلشده طراحی شدهاند.
یک واکنش Real-time PCR عادی چندین کنترل دارد. کنترل بدون الگو یا no-template control (NTC) آزمایشی است که در آن همه پرایمرها، پروبها و معرفهای لازم برای انجام شدن Real-time PCR وجود دارند، با این تفاوت که DNA اولیه الگو نداریم. NTC برای بررسی تشکیل سیگنال و یا عدم تشکیل آن در غیاب نوکلئیکاسید هدف است. این کنترل میتواند آلودگی و هرنوع فعلوانفعال پرایمرها و پروبها را که باعث مخدوششدن نتایج شود، تشخیص دهد.
کنترل خارجی (exogenous)، یک نوکلئیکاسید شناخته شده و یا قطعه DNA یا RNA سنتزشده است که با غلظت معینی در مخلوط واکنش قرار دارد. این کنترل میتواند به عنوان کنترل مثبت داخلی (Internal Positive Control= IPC) عمل کرده و مهار PCR و یک واکنش منفی حقیقی را از هم تمایز دهد؛ به این صورت که قطعه موردنظر را به همراه پرایمر مخصوصش به مخلوط واکنش اضافه میکنیم. اگر شرایط استاندارد باشد و واکنش درست انجام شود، باید هم این قطعه و هم توالی هدف Real-time PCR هر دو تکثیر شوند. درصورتیکه خود Real-time PCR نتیجه ندهد اما قطعه افزودهشده زیاد شود، واکنش منفی حقیقی رخ داده است و از علل آن میتوان به نبود توالی هدف Real-time PCR اشاره کرد. اگر هر دو قطعه تکثیر نشوند، مهار PCR رخ داده است.
کنترل داخلی (endogenous control) نوکلئیکاسیدی است که در مخلوط حاوی DNA هدف وجود دارد و درصورت استفاده از پرایمرها و پروبهای مناسب، میتواند در آزمایش Real-time PCR شناسایی شود. این قطعه به عنوان active reference به کار میرود و میتواند به نرمالیزه کردن تفاوتهایی که در مقدار کل DNA اولیه اضافهشده به آزمایشهای PCR وجود دارد، کمک کند.
پرکاربردترین کنترل داخلی، استفاده از ژنهای housekeeping است. در بررسی بیان ژن توسط Real-time PCR، این ژنها باید همواره وجود داشته و توسط سلول بیان شوند. از جمله این ژنها میتوان به ژنهایی اشاره کرد که برای تداوم بقای سلول و انجام فرایندهای حیاتی لازم هستند؛ مانند β-actin، GAPDH (glyceraldehyde 3-phospahte dehydrogenase) و ۱۸S RNA. همانطور که گفته شد، این ژنها باید در نمونه حاوی DNA هدف وجود داشتهباشند. بااینحال همانندسازی آنها میتواند در چاهک جداگانهای از پلیت آزمایش و یا در همان چاهکی که تکثیر توالی هدف صورت میگیرد و از طریق multiplex PCR و استفاده از پروبهای رنگی متفاوت از هم، انجام شود.
مقاله مرتبط: تکنیک Multiplex PCR
نرمالیزه کردن، اصلاح تغییراتی است که در شدت سیگنال نمونههایی یکسان رخ میدهد و واکنشهای Real-time PCR باید از لحاظ شدت سیگنال نرمالیزه شوند. این فرایند در دو مرحله باید صورت بگیرد: اصلاح تفاوتها در غلظت مواد اولیه PCR و نیز جبران تفاوت در مقادیر RNA استخراج شده از بافتهای مختلف (در صورت استفاده از Real-time PCR برای بررسی بیان ژن).
بسیاری از آزمایشهای Real-time PCR در پلیتهای میکروتیتر حاوی ۳۸۴-۴۸ چاهک انجام میگیرد. هرکدام از این چاهکها حاوی نمونه موردنظر و مواد اولیه PCR میباشند. اضافهکردن مواد توسط پیپت انجام میگیرد و انجام این کار به صورت پشت سرهم، باعث ایجاد اختلافاتی در غلظت مواد افزودهشده بین چاهکهای مختلف میگردد؛ برخی چاهک ها ممکن است مقادیر بیشتر یا کمتری از مواد را دریافت بکنند. این تفاوتها بین نمونههای متوالی ممکن است موجب متغیر شدن سطوح ژنهای مورد مطالعه شوند و اصلاح آنها با استفاده از passive reference صورت میگیرد. سیگنال ایجادشده هنگام انجام شدن فرایند تکثیر، با سیگنال ایجاد شده توسط این ماده که معمولا رنگ ROX است، مقایسه میشود. این ماده از آن جهت passive reference نامیده میشود که، چون نه به عنوان ماده اولیه در فرایند تکثیر شرکت کرده و نه باعث مهار آن میشود. این ماده تنها نوری قرمز رنگ را ایجاد میکند.
تصور کنید که در حال انجام آزمایش Real-time PCR هستید و به طور تصادفی داخل یکی از چاهکهای پلیت، ۲۰۰ng از mRNAهای استخراج شده از سلولهای کبدی و داخل دیگری ۱۰۰ng از کل mRNAهای استخراج شده از سلولهای عضلانی را میریزید. حتی اگر ژن هدف در هر دو نوع از سلولها در سطوح یکسانی بیان شود، در نهایت در نتیجه آزمایش به نظر خواهد رسید که ژن در سلولهای کبدی دو برابر سلولهای عضلانی بیان شده است. نرمالیزه کردن، که با تقسیم شدت سیگنال رنگ reference (رنگ آزاد شده حین انجام فرایند تکثیر) به شدت سیگنال رنگ passive reference انجام میگیرد، میتواند این خطاها را اصلاح کند. این تقسیم موجب ایجاد کمیتی به نام Rn میگردد.
کاربرد Real-time PCR
Real-time PCR در آزمایشگاههای تشخیصی میکروبیولوژی بسیار محبوب است و انواع مختلفی از تجهیزات و کیتهای تجاری به منظور تشخیص سریع عفونتهای ویروسی مختلف توسعه یافتهاند. PCR غالبا برای تعیین مقدار DNA در نمونه موردنظر به کار میرود. این موضوع در بررسی پیشرفت عفونتهای ویروسی با اندازهگیری میزان پاتوژنها کمککننده است.
PCR برای تعیین حضور توالی DNA یک میکروارگانیسم مشخص نیز مورد استفاده قرار میگیرد؛ پیش از آنکه نتیجه تستهای سرولوژیک و یا کشت مشخص شود. آزمایشهای Real-time PCR امکان حصول هر چه سریعتر به نتایج را فراهم میکنند. برخی از نتایج حتی در مدت زمانی کمتر از یک ساعت پس از نمونهبرداری حاضر میشوند. این موضوع خصوصا در مبارزه علیه استافیلوکوکوس اورئوس مقاوم به متیسیلین (MRSA)، اهمیت دارد؛ به این صورت که بیماران میتوانند به سرعت هنگام بستری شدن از لحاظ این باکتری تست شوند. افرادی که MRSA مثبت هستند، میتوانند قرنطینه شوند تا خطر ایجاد عفونت در سایر بیماران خصوصا آنهایی که در معرض خطر هستند، به حداقل برسد.
تکینک Real-time RT-PCR اخیرا بیش از پیش به عنوان وسیلهای برای سنجش میزان RNA مورد استفاده قرار میگیرد. از جمله کاربردهای این روش، تعیین میزان بیان یک ژن مشخص با اندازهگیری میزان mRNAهاست. ژن موردمطالعه میتواند ژنی باشد که در یک سلول سرطانی روشن شده است. در این حالت، سنجش میزان mRNAهای حاصل از آن، امکان بررسی پیشرفت سرطان و تاثیر درمانهای صورت گرفته را فراهم میکند.
تکینک Real-time RT-PCR اخیرا بیش از پیش به عنوان وسیلهای برای سنجش میزان RNA مورد استفاده قرار میگیرد. از جمله کاربردهای این روش، تعیین میزان بیان یک ژن مشخص با اندازهگیری میزان mRNAهاست. ژن موردمطالعه میتواند ژنی باشد که در یک سلول سرطانی روشن شده است. در این حالت، سنجش میزان mRNAهای حاصل از آن، امکان بررسی پیشرفت سرطان و تاثیر درمانهای صورت گرفته را فراهم میکند.
حساسیت فوقالعاده PCR تضمینکننده این موضوع است که بیماری باقی مانده حداقل (minimal residual disease= MRD) میتواند پس از درمان اختلال شناسایی شود. تشخیص سریع عود بیماری در انتخاب روش مناسب درمانی کمک کننده است. به عنوان مثال Real-time PCR میتواند در تشخیص لوسمیها و لنفومها از روی translocationهایی مانند t(9;22) که مشخصه لوسمی مزمن میلوئیدی (CML) است، سودمند باشد.
توانایی اندازهگیری دقیق میزان بیان ژنها در درک نحوه بیمار شدن سلولها و پیشبینی پاسخ آنها به درمان حیاتی است. چه تغییراتی در رونویسی میتوانند باعث سرطانی شدن سلولها شوند؟ در پاسخ به درمان و یا در مواجهه با یک عفونت ویروسی کدام ژنها روشن و کدامها خاموش میشوند؟
البته سنجش میزان بیان ژن توسط Real-time PCR نتایجی نسبی به دست میدهد؛ به آن معنی که مقدار دقیق mRNAهای ساختهشده از یک ژن را اندازهگیری نمیکند. در این روش ما تنها مقدار رونوشتهای تولیدشده را با برخی دیگر از ژنها مقایسه میکنیم. این تفاوت به صورت fold differences (این که چند برابر است) بیان می شود. این مقایسه نسبی به عنوان مثال میتواند برای تعیین تفاوت در بیان ژنهای heat shock در سلولهای سرطانی در مقایسه با سلولهای سالم انجام بگیرد. از دیگر کاربردها، مقایسه بیان یک ژن در یک بافت با بیان آن در بافتی دیگر، خصوصا زمانی که درمان به خصوصی انجام گرفته است، میباشد. ژنی که پاسخ آن سنجیده میشود، هدف و ژنی که با آن مقایسه میکنیم، calibrator نام دارد و معمولا نشاندهنده کنترلی است که روی آن درمانی صورت نگرفته است.

لطفا رفرنس این مطلب و بیان کنید برای پایان نامه ام لازم دارم
منبع رو ذکر کنید لطفا
بسيار عالي. من تو زمينه real time خيلي مشكل داشتم و تو چندين كارگاه هم شركت كرده بودم و متوجه بعضي مفاهيم نمي شدم. بسيار خوب و عالي توضيح داده شده بود. تشكر. موفق باشيد.