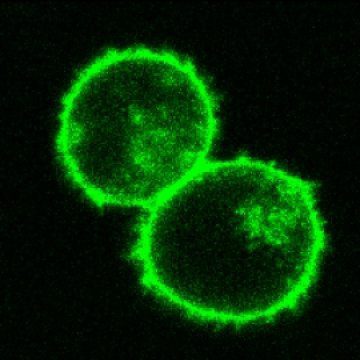
تیم تحقیق، راهنماهای CRISPR ایجاد کردهاند که باعث میشود پروتئین فلورسنت سبز تنها در موقعیتها و ساختارهای مشخص سلولی بیان شود.
دانشمندان دانشگاه سانفرانسیسکو باز برنامه ریزی سلولهای ایمنی انسان را تحت عنوان سلولهای T، بدون استفاده از ویروسها بمنظور وارد کردن DNA انجام دادهاند؛ دستاوردی که پیامدهای بسیاری در تحقیقات، پزشکی و صنعت خواهد داشت.
محققان انتظار دارند این تکنیک (رویکرد سریع، تطبیق پذیر و قابل توجیه از نظر اقتصادی که از تکنولوژی ویرایش ژن CRISPR بهره میبرد) بصورت وسیع در زمینه نوظهور سلول درمانی مورد استفاده قرار گیرد؛ همچنین باعث تسریع ایجاد درمانهای جدید و ایمنتر برای سرطان، خود ایمنی و دیگر بیماریها از جمله اختلالات مادرزادی نادر گردد.
مقاله مرتبط: عصری جدید در بیولوژی مولکولی با سیستم اصلاح ژنی CRISPR/Cas9
این روش جدید که در ۱۱ ژوئیه ۲۰۱۸ در نشریه Nature معرفی شدهاست، سیستم مولکولی “ببر و بچسبان” (cut and paste) قدرتمندی برای بازنویسی توالیهای ژنومی در سلولهای T انسان است. این روش بر پایه electroporation استوار است. electroporation، فرآیندی است که در آن، یک میدان الکتریکی بمنظور افزایش موقت در نفوذ پذیری غشای سلولها، ایجاد میشود. پس از بررسی هزاران متغیر در طول یک سال، محققان دانشگاه سانفرانسیسکو به این نکته دست یافتند زمانیکه مقدار مشخصی سلول T، DNA و “قیچی”های CRISPR با هم مخلوط شده و در معرض میدان الکتریکی مناسبی قرار گیرند، سلولهای T این عناصر را وارد خود کرده و توالیهای ژنومی مشخص شدهای را بطور دقیق در نواحی که با برش برنامه ریزی شده توسط CRISPR ایجاد میشود، وارد میکنند.
دکتر Alex Marson، دانشیار میکروبیولوژی و ایمونولوژی و عضو مرکز جامع سرطان Helen Diller Family دانشگاه سانفرانسیسکو گفت: “این، روشی سریع و تطبیق پذیر است که میتواند بمنظور تغییر، بهبود عملکرد و باز برنامه ریزی سلولهای T مورد استفاده قرار گیرد؛ همچنین با استفاده از این روش میتوانیم ویژگیهایی به این سلولها اعطا کنیم تا سلولهای سرطانی را از بین ببرند، عفونتها را شناسایی کنند یا پاسخ ایمنی اضافی را در بیماریهای خود ایمنی، کاهش دهند. اکنون ما در تمامی این زمینهها وارد شدهایم.”
Marson اذعان داشت این رویکرد علاوه بر سرعت و سهولت استفاده، این امکان را فراهم میآورد تا توالیهای با اهمیتی از DNA را وارد سلولهای T کنیم؛ توالیهایی که ویژگیهای جدیدی در این سلولهای ایجاد میکند. اعضای آزمایشگاه Marson موفقیتهایی در وارد کردن قطعات کوچک ماده ژنتیکی به سلولهای T با استفاده از electroporation و CRISPR کسب کردهاند، ولی تاکنون، تلاشهای بسیاری که توسط بسیاری از محققان بمنظور وارد کردن توالی طولانی DNA به سلولهای T انجام شدهاست، منجر به مرگ این سلولها گردیدهاست؛ و باعث پدید آمدن این باور شدهاست که توالیهای طولانی DNA، به مقدار بیشتری برای سلولهای T سمی هستند.
برای نشان دادن تطبیق پذیری و قدرت روش جدید، محققان از آن بمنظور بازسازی جهشهایی در DNA سلولهای T استفاده کردند که در کودکان مبتلا به یک خود ایمنی نادر ژنتیکی، منجر به ایجاد بیماری میشود؛ و همچنین سلولهای T دستکاری شدهای بمنظور جستجو و حذف سلولهای ملانومای انسانی ایجاد کردند.
ویروسها با تزریق ماده ژنتیکی خود از طریق غشای سلولی باعث عفونت میشوند. از دهه ۱۹۷۰، دانشمندان از این قابلیت ویروسها بهره بردهاند؛ بطوریکه ویژگیهای عفونی ویروسها را از بین میبرند و از “وکتورهای ویروسی” بمنظور انتقال DNA به درون سلول در مواردی مانند تحقیقات، ژن درمانی و مثال اخیر که اکثر افراد با آن آشنایی دارند یعنی ایجاد CAR T-cells مورد استفاده در ایمونوتراپی سرطان، استفاده میکنند.
سلولهای T مهندسی شده توسط ویروسها، اکنون توسط اداره غذا و دارو ایالات متحده بمنظور مبارزه با انواع مشخصی از لوسمی و لفنوم تایید شدهاند. ولی ساخت وکتورهای ویروسی فرآیندی هزینهبر و پر زحمت است و کمبود وکتورهای با درجه بالینی به تنگنای تولیدی هم برای ژن درمانی و هم برای درمانهای بر پایه سلولی منجر شدهاست. حتی در صورت در دسترس بودن، وکتورهای ویروسی ایدهآل نیستند، زیرا آنها ژنها را بصورت تصادفی وارد ژنوم سلول میکنند که میتواند باعث آسیب ژنهای سالم شده یا ژنهای جدید بیان شده را از مکانیسمهای کنترلی سلول که عملکرد طبیعی سلول را تضمین میکنند، خارج کند. این محدودیتها که بصورت بالقوه میتواند به عوارض جانبی جدی منجر گردد، دلیل نگرانیها در ژن درمانی و سلول درمانیهایی همچون ایمونوتراپی بر پایه CAR T cells است.
مولف اول پژوهش Theo Roth، دانشجوی پزشکی در برنامه تربیت دانشمند پزشکی دانشگاه سانفرانسیسکو و طراح و رهبر مطالعه جدید در آزمایشگاه Marson اذعان داشت: “نزدیک به ۳۰ سال است تلاشها در جهت وارد کردن ژنهای جدید به درون سلولهای T صورت میگیرد. پس از مدت اندکی نباید نیازی به شش یا هفت نفر در آزمایشگاه بمنظور مهندسی سلولهای T توسط ویروسها باشد. و اگر تعداد آزمایشگاههای بیشتری در این زمینه (مهندسی سلولهای T) و وارد کردن توالیهای پیچیدهتر DNA فعالیت کنند، امکان زیادی برای افزایش سرعت پیشرفت سلول درمانی در دسترس خواهد بود.”
پس از نزدیک به یک سال آزمون و خطا، Roth نرخ جمعیت سلولهای T، کمیت DNA و فراوانی CRISPR را که در کنار یک میدان الکتریکی با پارامترهای مشخص در جهت ویرایش دقیق و کارآمد ژنوم سلول T فعالیت میکنند، مشخص کرد.
بمنظور معتبر ساختن این یافتهها، Roth، عامل CRISPR را بمنظور نشاندار کردن دسته خاصی از پروتئینهای سلول T با پروتئین فلورسنت سبز (GFP) هدایت کرد. نتیجه بسیار اختصاصی بود و اثرات “خارج هدفی” بسیار کمی داشت: هر الگو CRISPR برای ساختارهای تحت سلولی، بمنظور نشان گذاری توسط GFP طراحی شدهبود و زیر میکروسکوپ برنگ سبز میدرخشید.
سپس مطالعات تکمیلی بمنظور تایید امکان استفاده درمانی از تکنیک جدید، طراحی شد. Roth، Marson و همکارانش نشان دادند که چگونه سلولهای T نشاندار میتوانند علیه بیماریهای خود ایمنی یا سرطان مورد استفاده قرار گیرند.
در مثال اول، Roth و همکارانش از سلولهای T استفاده کردند که توسط دکتر kevan Herold از دانشگاه علوم پزشکی Yale فراهم شدهبود. این سلولها، از ۳ خواهر و برادر مبتلا به یک بیماری خود ایمنی شدید و نادر که از مدتها پیش به درمان مقاوم شدهبود، استخراج شدهبودند. توالی یابی ژنومی نشان داد که سلولهای T در این کودکان، حامل جهشی در ژن IL2RA بودند. این ژن حاوی دستوراتی برای رسپتور سطح سلولی است که برای تکامل سلولهای T تنظیمی یا Treg ضروری میباشد. این سلولها، دیگر سلولهای ایمنی را تحت کنترل داشته و از بروز خود ایمنی جلوگیری میکنند.
با تکنیک CRISPR غیر ویروسی، تیم دانشگاه سانفرانسیسکو قادر بود تا بصورت سریع، نقص IL2RA را در سلولهای T این کودکان ترمیم کند، و همچنین قادر بود تا سیگنالهای سلولی را که تحت اثر این جهش مختل شدهبودند، بازیابی کند. در درمان CAR-T، سلولهای T که از بدن استخراج شدهاند بمنظور توانایی مبارزه با سرطان، مهندسی میشوند. سپس آنها به بدن بمنظور هدف قرار دادن تومور، بازگردانده میشوند. محققان امید دارند رویکرد مشابهی در درمان بیماریهای خود ایمنی که از عملکرد مختل شده سلولهای T تنظیمی ناشی میشود، کارآمد واقع شود؛ مانند شرایطی که در سه کودک حامل جهشهای IL2RA مشاهده شد.
در مجموعه دوم آزمایشها که در همکاری با دکتر Cristina Puigsaus و دکتر Antoni Ribas از انستیتو ایمونوتراپی Parker در دانشگاه سانفرانسیسکو انجام شد، دانشمندان بصورت کامل، رسپتورهای native T cells را با رسپتورهای جدیدی که بصورت اختصاصی بمنظور جستجوی انواع مشخصی از سلولهای ملانومای انسانی مهندسی شدهبودند، تعویض کردند. رسپتورهای سلولهای T، سنسورهایی هستند که سلولها از آنها بمنظور شناسایی بیماری یا عفونت استفاده میکنند؛ و در ظروف آزمایشگاه، سلولهای مهندسی شده بصورت کارآمدی، سلولهای ملانوما را با گذر از سلولهای دیگر، مورد هدف قرار دادند. این مورد، نشان از حاکمیت اختصاصی بودن است که یک هدف اصلی در پزشکی دقیق سرطان محسوب میشود.
بدون استفاده از ویروسها، محققان قادر بودند تا تعدادی زیادی از سلولهای مهندسی شده توسط CRISPR را ایجاد کنند که رسپتورهای سلولی T جدیدی بیان میکردند. زمانیکه این سلولها به بدن موش حاوی سلولهای ملانومای انسانی منتقل شدند، به محل تومور مهاجرت کرده و فعالیت ضد توموری از خود بروز دادند.
Marson گفت: “استراتژی جایگزینی رسپتور سلول T میتواند برای هر نوع رسپتور سلول T تعمیم داده شود. با بکارگیری این تکنیک، میتوانیم در توالی ژنومی ناحیه خاصی را برش داده و الصاق کنیم و صفحه جدیدی در ژنوم را بازنویسی کنیم.”
Roth گفت بدلیل اینکه این روش، تولید ردههای مختلف سلولهای T زنده را در کمی بیش از یک هفته ممکن میسازد، فضای تحقیقاتی آزمایشگاه Marson دگرگون شدهاست. ایدههای مطالعاتی که قبلا بدلیل موانع ناشی از وکتورهای ویروسی، بسیار مشکل و هزینهبر تلقی میشد، اکنون توانایی آن را دارند تا مورد بررسی واقع شوند. ما بر روی ۲۰ ایده “دیوانه کننده” فعالیت خواهیم داشت. زیرا توانایی آن را داریم تا الگوهای CRISPR را بصورت بسیار سریع تولید کنیم و مادامی که ما الگو را بدست بیاوریم، میتوانیم آن را به سلول T وارد کرده و رشد آن را سریعا رقم بزنیم.”
Marson، موفقیت روش جدید را در گرو “ثبات قدم مطلق” Roth در رویارویی با باور شایع که وکتورهای ویروسی ضروری هستند و سلولهای T تنها میتوانند توالیهای کوتاهی از DNA را تحمل کنند، میداند. وی اذعان داشت: “Theo ما را متقاعد کرد اگر بتوانیم شرایط مناسب را برقرار سازیم، قادر خواهیم بود این محدودیتها را برطرف سازیم. و او تلاشی مثال زدنی در بررسی شرایط بسیار متفاوت داشت: نرخ CRISPR به توالی DNA؛ روشهای مختلف کشت سلولی؛ جریانهای مختلف الکتریکی. با بهینه ساختن هر یک از این پارامترها و با کنار هم قرار دادن بهترین شرایط، او قادر بود این نتیجه شگفتآور را بدست آورد.”