با وجود دههها آشنایی با علت ایجاد ایجاد بیماری کورودرمیا و پاتوژنسیتهی دقیق آن، تا کنون برای متوقف ساختن یا آهسته کردن روند تخریب شبکیه در کورودرمیا هیچ درمان ثابت شدهای وجود ندارد. ويژگیهای ملکولی و بالینی کورودرمیا، آن را به یک کاندید ایدهآل برای ژندرمانی تبدیل کرده است.
با توجه به اینکه پروتئین RPE1 در حالت عادی در تمامی سلولهای بدن بیان میشود، سوال مهم درمورد آسیبشناسی کورودرمیا این است که آیا یک نوع سلول (لایه بافتی) به عنوان مکان اولیه تخریب عمل میکند (و سپس موجب تخریب سایر لایههای بافتی میشود) یا اینکه تخریب همزمان و به طور مستقل در انواع مختلفی از سلولها (لایههای بافتی) آغاز میشود؟ پاسخ این سوال نوع سلولهایی را که باید برای ژندرمانی هدفگذاری شوند، مشخص میکند. با توجه به اینکه سه لایهای که تخریب میشوند (مشیمیه، لایه رنگدانهای شبکیه (RPE) و فتورسپتورها) کاملاً وابسته به یکدگیر هستند، پاسخ به این سوال دشوار است. برای مثال در صورت تخریب RPE (در اثر سایر بیماریهای چشمی مانند مایوپی یا دژنراسیون وابسته به سن ماکولا)، فتورسپتورهایی که از نظر ژنتیکی سالم بوده و عملکرد نرمالی دارند نیز تخریب خواهند شد. و یا در پاسخ به از بین رفتن فتورسپتورها (در بیماری آماس رنگیزهای شبکیه)، شکل و توزیع سلولها RPE نیز تغییر خواهد یافت.
به طور کلی پژوهشهای انجام شده نشان میدهد که نقص RPE1 به طور خودکار و مستقل موجب مشکلات سلولی در چشم میشود که هم RPE و هم فتورسپتورها میتوانند نواحی اولیه آغاز بیماری در نظر گرفته شوند. بدین ترتیب رویکرد منطقی این است که در ژندرمانی کورودرمیا وکتورها هم برای فتورسپتورها و هم برای سلولهای RPE طراحی شوند.
انتخاب وکتور مناسب
وکتورهای AAV در ژندرمانی بیماریهای چشم بسیار رایج هستند. یکی از نکات مهم در انتخاب وکتور مناسب مقدار ماده ژنتیکی است که میتوان وارد ذرات ویروسی کرد که به عنوان ظرفیت یا محدودیت بستهبندی شناخته میشود. وکتور AAV ظرفیتی کمتر از ۵ کیلو باز از DNA تک رشتهای دارد. اگرچه این مقدار بسیار کم است و یک محدودیت برای استفاده از وکتورهای AAV محسوب میشود، اما این مقدار برای توالی REP1 (۱.۹ کیلو باز) بیشتر از مقدار مورد نیاز بوده و حتی اجازه استفاده از پروموترها و سایر توالیهای تنظیمکننده را نیز میدهد. یکی دیگر از عوامل مهم در استفاده از وکتورهای ویروسی مطمئن شدن از رسیدن ویروس به سلولها و بافت مورد نظر است. زیرگروههای مختلفی از وکتورهای AAV وجود دارد که یر یک پروتئینهای پسید اختصاصی خود را دارند (سروتایپها). این سروتایپهای مختلف هریک گرایش سلولی متفاوتی دارند . به طور اختصاصی نوع خاصی از سلولها را هدف قرار میدهند. بسیاری از وکتورهای AAV به طور موثری نورونها را هدف قرار میدهند اما فقط سروتایپ ۲ قادر است همزمان فتورسپتورها و لایه رنگدانهای شبکیه (RPE) را هدفگذاری کند. از آنجایی که در کورودرمیا فتورسپتورهای استوانهای و سلولهای RPE هردو باید مورد هدف قرار گیرند، AAV2 وکتور مناسبی برای انجام این روند درمانی میباشد.
در لایهی بافتی مربوط به فتورسپتورها AAV2 بیشتر از سلولهای مخروطی، سلولهای استوانهای را آلوده میکند. این مورد نیز در درمان کورودرمیا سودمند است زیرا در فتورسپتورهای مخروطی عدم حضور پروتئین RPE1 به طور ذاتی تاثیری در عملکرد آنها ندارد؛ بنابرین برای جلوگیری از عوارض جانبی بهتر است تا حد امکان ژن بیگانه وارد فتورسپتورهای مخروطی نشود. اگرچه هنگام استفاده از AAV2 در یک شبکیه درحال تخریب، نمیتوان به طور قطع از آلوده نشدن سلولهای مخروطی مطمئن بود. برای مثال، در غیاب سلولهای استوانهای، سلولهای مخروطی در دسترس ذرات ویروسی قرار گرفته و اتمال آلوده شدنشان افزایش مییابد. اگرچه پیشبینی دقیق اینکه در یک شبکیه درحال تخریب AAV2ها تنها موجب بیان ژن انتقال یافته در سلولهای استوانهای خواهند شد غیرممکن است، اما میتوان مطمئن بود که سلولهای استوانهای بیشتر از سلولهای مخروطی به این وکتور آلوده میشوند.
AAV به طور طبیعی انسانها را آلوده میکند. اگرچه تا به حال بیماری خاصی را در انسان ایجاد نکرده است اما آنتیبادیهایی علیه کپسید حالت وحشی این ویروسها به مقدار قابل توجهی در خون یافت میشود. با این حال این ویروس در آزمایش بر روی پریماتها کاملاً ایمن بوده و طی تزیق تحت شبکهای این وکتور ویروسی برای درمان بیماری لبر (LCA2) هیچگونه عوارض جانبی یا پاسخ ایمنولوژیکی ناخواستهای ایجاد نشد و بیان ژن انتقال یافته (RPE65) کاملاً پایدار بود. ژندرمانی موفقیتآمیز بیماری لبر از طریق وکتور AAV2 دلیل محکم دیگری برای استفاده از این وکتور در درمان کورودرمیا است.
بنابراین با توجه به گرایش AAV2 به سلولهای مورد هدف، ظرفیت بستهبندی توالی کامل REP1، امنیت و موثر بودن آن در ژندرمانی یک بیماری چشم متفاوت (لبر)، این ویروس وکتور مناسبی برای جایگزینی ژن CHM برای ژندرمانی کورودرمیا است. با توجه به اینکه AAV2 انتخاب قانعکنندهای است، از سایر انواع ویروسها مانند لنتیویروسها و یا آدنوویروسها استفاده نمیشود.
طراحی وکتور: به دلیل اینکه RPE1 همیشه و همهجه بیان میشود نیازی به استفاده از توالی پروموتر در انتهای ۵’ برای تنظیم بیان ژن نیست. به جای آن ترکیبی از سایتومگالوویروس انسانی (CMV) با پروموتر بتا-اکتین مرغ به عنوان یک پروموتر القا کننده بیان دائمی ژن انتخاب میشود. این پروموتر با نام CBA و یا CAG شناخته میشود و برای اولین بار در ژاپن ساخته شده است. این پروموتر در ژندرمانی شبکیه بسیار کارآمد بوده است و پایداری بالایی در القا بیان ژن داشته است. از توالیهای دیگری نیز میتوان برای بهتر کردن بیان ژن درمانی در کاست ژنی استفاده کرد. در آزمایشهای انجام شده، گنجاندن عنصر تنظیمی ویروس آلوده کننده سنجاب کوهستانی (WPRE)، در پاییندست توالی کد کننده پروتئين، بیان ترانس ژن را در مغز موش، سلولهای کلیه رویان انسان و پوست انسان، افزایش داده است. اگرچه جنین عنصری پیشتر در کارآزماییهای ژندرمانی شبکیه استفاده نشده است اما توالی WPRE توسط سازمان FDA تایید شده است (همچنین استفاده از AAV2-GAD در ژندرمانی بیماری پارکینسون هیچگونه عوارض جانبی به همراه نداشته است). انتخاب نوع توالی سیگنال پلیآدنیلاسیون نیز در افزایش بیان ژن موثر است. توالی پلیآدنیلاسیون هورمون رشد Bovine نسبت به سایر توالیهای پلیآدنیلاسیون مانند SV40 و human collagen polyA، بیان ژن را تا ۳ برابر افزایش میدهد. و این بیان ژن افزایش یافته مستقل از نوع پروموتر بالادست و یا ترانس ژن است.
بنابراین سطح بیان ترانس ژن AAV را میتوان با ترکیب یک پروموتر مناسب و سیگنال پلیآدنیلاسیون به همراه گنجاندن توالی WPRE، به حداکثر رساند. بدین ترتیب میتوان حتی با دوز پایینی از وکتور AAV به نتیجه درمانی مطلوب رسید. همچنین پایین بودن دوز وکتور احتمال ایجاد پاسخ ایمنی علیه پروتئینهای ویروسی را در بدن بیماران کاهش میدهد (ممکن است به نظر برسد استفاده از سایر سروتایپهای AAV که به طور ذاتی بیان ژن بالاتری دارند (مانند AAV8) کارآمدتر از موارد گفته شده باشد؛ اما باید در نظر گرفت که در طولانی مدت، بی خطر بودن و پایداری بیان ژن تنها در وکتورهای AAV2 ممکن است بنابراین افزایش بیان ژن در کاست ژنی مطلوبتر از تعویض نوع کپسید است).
کاستهای ژنی AAV باید توسط توالیهای تکراری انتهایی محدود شوند. این توالیها بخشی از ژنوم AAV وحشی (موجود در طبیعت) هستند و برای بستهبندی DNA تک رشتهای در داخل ویریون ضروری میبشاند.
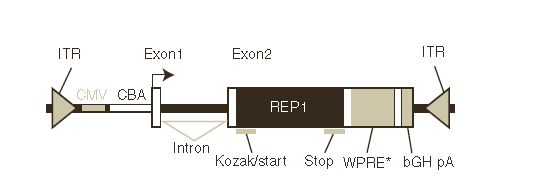
و البته جزء نهایی لازم در کاست ژنی توالی cDNA کد کننده پروتئین REP1 انسانی است. به طور کلی هر ویریون AAV یک توالی تک رشتهای DNA (۴.۲ کیلوباز) دارد که شامل CMV تقویتکننده، پروموتر ترکیبی CBA، cDNA از توالی REP1 انسانی، WPRE و توالی پلیآدنیلاسیون هورمون رشد Bovine است. و تمامی این توالیها باید توسط توالیهای تکراری انتهایی محدود شوند. ساختار یک وکتور AAV-REP1 در تصویر زیر قابل مشاهده است.
با وجود انتخاب و طراحی یک وکتور مناسب، برای ژندرمانی کورودرمیا همچنان با برخی چالشها مواجه هستیم؛ زیرا این نوع درمان اولین ژندرمانی تخریب شبکیه است که به طور اختصاصی فتورسپتورها را هدف قرار میدهد (در بیماری لبر سلولهای RPE هدف اولیه ژندرمانی هستند). درمان باید زمانی انجام گیرد که ساختار شبکیه نسبتاً سالم است و بینایی در مرکز لکه زرد (FOVEA) باقیمانده است. بنابراین خطرات احتمالی قابل توجه هستند، زیرا ممکن است انتقال وکتور موجب جدا شدن گوده مرکزی (FOVEA) و از بین رفتن کامل بینایی در بیماری با حدت بینایی خوب شود. اگرچه درصورتیکه هیچ درمانی نیز انجام نشود بیمار نهایتاً بینایی خود را درنتیجهی تخریب شبکیه از دست خواهد داد. با اینکه هیچ شواهدی از سمی بودن RPE1 وجود ندارد و این پروتئین در تمامی سلولهای هستهدار انسانهای سالم وجود دارد اما ممکن است تزریق وکتور موجب بیان بیش از حد RPE1 شده و اثرات زیانآوری بر سلولهای شبکیه داشته باشد (به خصوص روی عملکرد فتورسپتورها). برای اطمینان از اینکه فتورسپتورها در معرض خطر نیستند، در کارآزماییهای بالینی از دوز بسیار پایینی از وکتور استفاده میشود. همچنین به دلیل اینکه پروتئین RPE1 در محیطی بیان خواهد شدکه قبلاً آثاری از این پروتئین وجود نداشت از نظر تئوری ممکن است پاسخ ایمنی علیه آن ایجاد شود که استفاده از دوز پایین وکتور این نگرانی را از بین میبرد.
درحال حاضر ایمنی و اثرگذاری ژندرمانی کورودرمیا در ۱۸ منطقه کلینیکی در آمریکا، اروپا، کانادا و… آزمایش میشود.