خاموشی ژن نوعی تنظیم بیان ژن در سلول است که مانع از بیان یک ژن خاص میشود. خاموشی ژن میتواند هم هنگام ترجمه و هم هنگام رونویسی رخ دهد. روشهایی که برای خاموشی ژن استفاده میشوند به طور اختصاصی برای درمان بیماریهایی ماننند سرطان، بیماریهای عفونی و نورودژنراتیو، در حال پیشرفت هستند. خاموشی ژن اغلب با سرکوب ژن اشتباه گرفته میشود؛ زمانی که یک ژن خاموش میشود بیان آن کاهش مییابد، در مقابل، سرکوب یک ژن موجب حذف کامل آن از ژنوم ارگانیسم شده و بدین ترتیب آن ژن دیگر بیان نخواهد شد. با این حال خاموشی ژن نوعی مکانیسم سرکوب ژن درنظر گرفته میشود زیرا روشهایی مانند RNAi، CRISPR یا siRNA که برای خاموشی ژن استفاده میشوند بیان ژن را حداقل تا ۷۰ درصد کاهش میدهند (اما موجب حذف کامل آن نمیشوند).
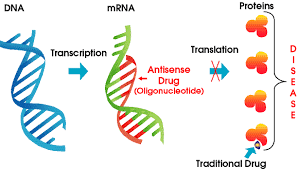
الیگونوکلئوتیدهای آنتیسنس
الیگونوکلئوتیدهای آنتیسنس در سال ۱۹۷۸ توسط Mary Stephenson و Paul Zamecnik کشف شدند. الیگونوکلئوتیدهای که قطعات نوکلئیک اسیدی کوتاهی هستند، زمانی که به سلول اضافه شوند، به ملکولهای mRNA هدف مکمل خود میچسبند. این ملکولها از RNA یا DNA تک رشتهای که به طور معمول ۱۳-۲۵ نوکلئوتید طول دارند، تشکیل شدهاند. الیگونوکلئوتیدهای آنتیسنس میتوانند بیان ژن را از دو طریق تحت تاثیر قرار دهند:
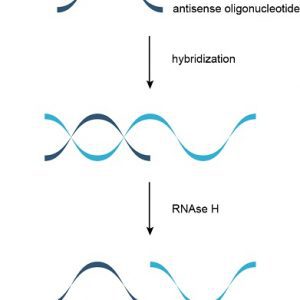
۱. مکانیسم وابسته به RNase H[۱]: الیگونوکلئوتیدهای وابسته به RNase H موجب تخریب ملکولهای mRNA هدف میشوند.
۲. مکانیسم بلوکه کردن از طریق اثرات فضایی: این الیگونوکلئوتیدها مانع از ترجمه ملکولهای mRNA میشوند.
اغلب داروهای آنتیسنس از طریق مکانیسم وابسته به RNase H عمل میکنند که طی آن RNase H رشتهی RNA از مارپیچ دوگانهی RNA/DNA را هیدرولیز میکند. این مکانیسم موثرتر است و موجب کاهش ۸۰-۹۵ درصد در بیان پروتئین و mRNA میشود.
مکانیسم وابسته به RNase H
ریبوزیمها
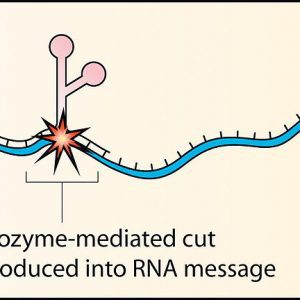
ریبوزیمها ملکولهای RNA کاتالیزوری هستند که برای مهار بیان ژن استفاده میشوند. این ملکولها با از بین بردن ملکولهای mRNA مانع از بیان ژن تولید کنندهی آن میشوند. Sidney Altman و Thomas Cech در سال ۱۹۸۹ با کشف ملکولهای RNA کاتالیزوری، RNase P و اینترون ریبوزیمهای گروه II، موفق به دریافت جایزه نوبل شدند. موتیفهای متعددی از ریبوزیمهای وجود دارد؛ ازجمله ریبوزیمهای کلهچکشی، سنجاق سر، ویروس هپاتیت دلتا، گروه I، گروه II و RNase P. ریبوزیمهای کلهچکشی، سنجاق سر و ویروس هپاتیت دلتا (HDV) به طور معمول در ویروسها یا RNAهای ویروئيد یافت میشوند. این موتیفها قادرند اتصال خاص فسفودیاستر روی ملکول mRNA را از بین ببرند. یوکاریوتهای پستتر و تعداد اندکی از انواع باکتریها دارای ریبوزیمهای گروه I و II هستند. این موتیفها با شکستن و اتصال پینوندهای فسفودیاستر به هم، خود به خود RNA را پیرایش میکنند. آخرین گزوه از موتیفهای ریبوزیم، ریبوزیم RNase P، در باکتری E. coli یافت میشود و با توانایی خود در شکستن پیوندهای فسفودیاستر پیشگامهای متعدد tRNA، هنگامی که به کوفاتور پروتئين متصل هستند، شناخته میشود.
مکانیسم کلی کاتالیزوری ریبوزیمها مشابه مکانیسم پروتئین ریبونوکلئاز است. این RNAهای کاتالیزور به یک جایگاه خاص متصل شده و با یکی از گروههای اکسیژنی خود به فسفاتهای اطراف آن، روی ساختار RNA حمله میکنند. این گروه اکسیژنی به عنوان نوکلئوفیل[۲] عمل میکند. محصولات نهایی واکنش RNAهای شکسته شدهای با یک فسفات حلقوی و یک انتهای ۵’ هیدروکسیل هستند. این مکانیسم به طور گستردهای توسط دانشمندان برای ایجاد برشهایی با توالی خاص روی ملکول mRNA هدف استفاده میشود. علاوه بر آن از ریبوزیمها میتوان برای خاموش کردن ژنهایی که موجب بیماری میشوند استفاده کرد.
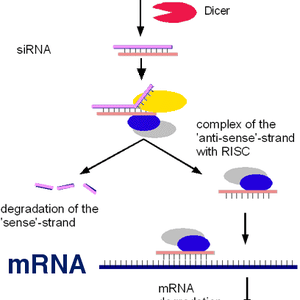
 RNA مداخلهگر (RNAi)
RNA مداخلهگر (RNAi)
RNA مداخلهگر فرآیندی است که به طور طبیعی برای تنظیم بیان ژن توسط سلولها استفاده میشود. Andrew Fire و Craig Mello در سال ۲۰۰۶ برای این کشف خود موفق به دریافت جایزه نوبل شدند. این روش از خاموشی ژن با وارد شدن یک ملکول RNA دو رشتهای (dsRNA) به داخل سلول آغاز میشود، dsRNA مسیر RNAi را راهاندازی میکند. ملکول دو رشتهای سپس توسط آنزیمی به نام Dicer به اجزا دو رشتهای کوچکتر شکسته میشود. این اجزا کوچکتر که شامل RNA خاموشگر (siRNA) و میکرو RNA (miRNA) میباشند، طولی درحدود ۲۱-۲۳ نوکلئوتید دارند. این اجزا در یک زیرواحد پروتئینی چندگانه به نام IRSC[۳] گردهم میآیند، این کمپلکس پروتئینی دارای آنزیمی به نام Argonaute است که از اجزای اصلی مسیر RNA مداخلهگر میباشد. یکی از رشتههای ملکول RNA (رشتهی راهنما یا آنتیسنس) به کمپلکس پروتئینی RISC متصل شده و رشتهی دیگر (رشتهی پیامبر یا سنس) تخریب میشود. رشتهی آنتیسنس که متصل به RISC باقی میماند خاموش کردن توالی اختصاصی mRNA هدف را هدایت میکند. به طور کلی، ژنها میتوانند از دو طریق خاموش شوند: به وسیلهی ملکول siRNA که موجب شکسته شدن mRNA هدف در داخل هسته میشود یا از طریق ملکولهای miRNA که mRNA را در مرحلهی ترجمه سرکوب میکنند. با شکسته شدن یا سرکوب ترجمهی ملکول mRNA، ژن بیان کنندهی آن غیرفعال میشود. اعتقاد بر این است که RNAi به عنوان مکانیسم دفاعی سلول در برابر مهاجمانی مانند RNA ویروسها و یا برای مقابله با تکثیر ترانسپوزونها[۴] در داخل DNA سلول، تکامل یافته است. RNA ویروسهاو ترانسپوزونها هردو میتوانند به شکل RNA دو رشتهای حضور داشته و موجب فعال شدن مسیر RNAi شوند. درحال حاضر siRNAها به طور گسترده برای سرکوب بیان ژن خاص و برای ارزیابی عملکرد ژنها استفاده میشوند.
نواحی غیرترجمهای ۳’ و میکرو RNAها
نواحی غیرترجمهای ۳’ (۳′-UTR) روی RNAهای پیامبر (mRNA) اغلب دارای توالیهای تنظیمی هستند که موجب خاموش شدن ژن پس از رونویسی میشوند. چنین ۳′-UTR هایی دارای جایگاه اتصال برای میکرو RNAها (miRNA) و پروتئینهای تنظیمی میباشند. تعداد زیادی از miRNAهای اختصاصی با اتصال به جایگاههای خاص روی ۳′-UTR، بیان ژن mRNA هدف را از طریق مهار ترجمه یا مستقیماً با تقلیل رونویسی، کاهش میدهند. مکانیسم مورد استفاده در این روش نیز مشابه RNA مداخلهگر است. همچنین ۳′-UTR ممکن است نواحی خاموش کنندهای داشته باشد که به پروتئینهای سرکوب کننده بیان mRNA متصل شوند.
۳′-UTR اغلب دارای عناصر واکنشدهنده به میکرو RNA است (MRE). MREها توالیهایی هستند که miRNA به آن متصل شده و ژن را خاموش میکند. در میان موتیفهای تنظیمی ۳′-UTR (مانند نواحی خاموش کننده)، MREها شایعترین آنها بوده و تقریباً نیمی از موتیفها را شامل میشوند.
مطالعات مستقیم نشان میدهند یک miRNA منفرد میتواند پایداری صدها mRNA متفاوت را کاهش دهد. پژوهشهای دیگر نیز شنان دادهاند که یک miRNA قادر است تولید صدها پروتئین را سرکوب کند اما این سرکوب اغلب خفیف است.
به نظر میرسد اثر تنظیمی miRNA روی بیان ژن در سرطان بسیار مهم است. برای مثال در سرطان روده ۹ miRNA که به طور اپیژنتیکی تغییر یافتهاند، شناسایی شدهاند. این miRNAهای تغییر یافته موجب نقص در آنزیمهای تنظیمی DNA میشوند. اثر تنظیمی miRNA در اختلالات عصبی مانند اسکیزوفرنی، اختلال دوقطبی، افسردگی شدید، پارکینسون، آلزایمر و اوتیسم نیز مهم است.
۱. ریبونوکلئاز H (RNase H یا RNH) گروهی از آنزیمهای اندونوکلئاز با توالی غیراختصاصی است که از طریق مکانیسم هیدرولیتیک، برش RNA را در پیشمادهی RNA/DNA کاتلیز میکند.
۲. گونهای شیمیایی است که به یک الکتروندوست برای تشکیل یک پیوند شیمیایی ، زوجالکترون میدهد.
۳. RNA-induced silencing complex
۴. به توالیای از DNA گفته میشود که میتواند جایگاه نسبی خود بر روی ژنوم پس و پیش کند.

 RNA مداخلهگر (RNAi)
RNA مداخلهگر (RNAi)