رفتار ژنهای افراد تنها مربوط به توالی ژنهای آنان نیست؛ فاکتورهای اپی ژنتیکی نیز این موضوع را تحت تاثیر قرار میدهند. تغییر در این فاکتورها میتواند نقش مهمی در بیماریزایی ایفا کند و رابطه میان اپی ژنتیک و بیماری را تبیین کند.
مقاله مرتبط: چاقی و اپی ژنتیک
تاثیرات محیط خارجی روی ژنها میتواند باعث بیماری شود و برخی از این تاثیرات ممکن است در انسانها به ارث برسند. طراحی مطالعاتی که چگونگی تاثیر فاکتورهای محیطی روی نسل بعدی را بررسی میکنند، دشوار است. با این حال، در قسمتهایی از جهان که سیستمهای اجتماعی بسیار متمرکز میباشند، اطلاعات مربوط به تاثیرات محیط روی خانوادهها میتواند به دست آید. به عنوان مثال دانشمندان سوئدی روی تاثیر تغذیه بر میزان مرگ ناشی از بیماریهای قلبی عروقی و دیابت و نیز وراثت این تاثیرات از والدین به فرزندان و نوهها، مطالعهای انجام دادند. محققان میزان دسترسی افراد مورد مطالعه به غذا را با بررسی میزان محصول سالانه و قیمت غذا در طول سه نسل، و با آغاز از دهه ۱۸۹۰، تخمین زدند. نتایج حاکی از آن بود که در صورت نبود غذای کافی برای پدر در دورانهای حساس رشد و درست پیش از بلوغ، فرزندان پسر با احتمال کمتری در اثر بیماریهای قلبی عروقی میمردند. مرگ مرتبط با دیابت در فرزندان در صورتیکه پدربزرگ پدری در دوران حیاتی رشد خود دسترسی فراوانی به غذا داشت، افزایش مییافت، اما در صورت فراوانی غذا در پدر، کاهش مییافت. این نتایج نشان دادند که رژیم غذایی میتواند در ژنها تغییراتی ایجاد کند که از طریق پدر منتقل میشوند و این تغییرات افراد را به ابتلا به بیماریهای خاصی مستعد میکند. اما این تغییرات کدامها هستند و چگونه به خاطر سپرده میشوند؟ پاسخ این سوالات در مفهوم اپیژنتیک قرار دارد.
اپی ژنتیک چیست و چگونه ژنها را تحت تاثیر قرار میدهد؟
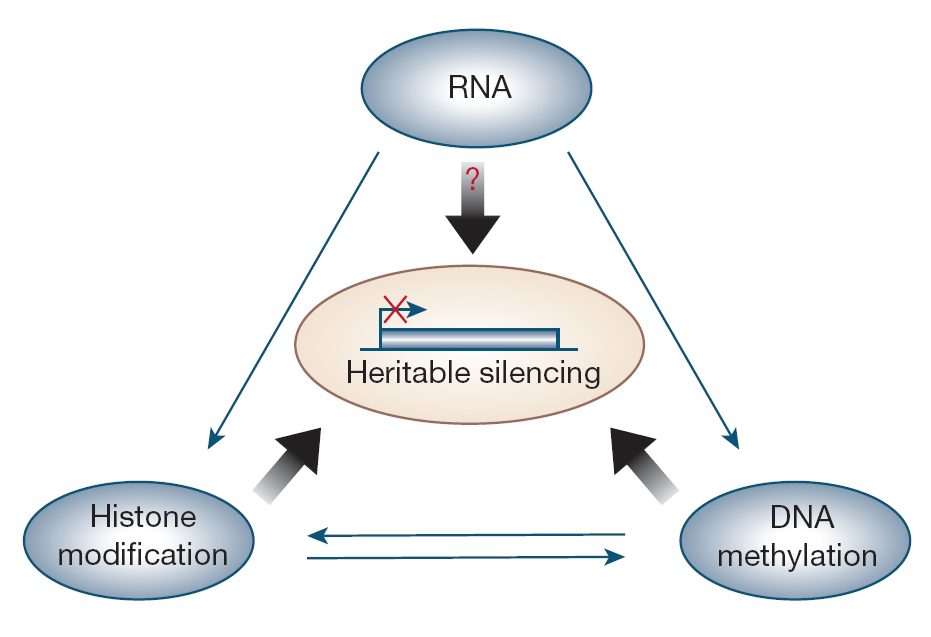
اپیژنتیک، توسط فاکتورهایی به غیر از توالی DNA، کنترل ژنتیکی را انجام میدهد. اپیژنتیک میتواند ژنها را خاموش و روشن کرده و نوع پروتئین رونویسیشده را تعیین میکند.
مقاله مرتبط: اپیستازی: فعلوانفعالات ژنها و بیان فنوتیپی بیماریهای پیچیده مانند آلزایمر
اپیژنتیک در بسیاری از فرایندهای نرمال سلولی دخیل است. این حقیقت را در نظر بگیرید که سلولهای ما همه DNA یکسانی دارند ولی بدن از انواع مختلفی از سلولها تشکیل شده است: نورونها، سلولهای کبدی، سلولهای پانکراس، سلولهای التهابی و … . این موضوع چگونه ممکن است؟ به طور خلاصه، سلولها، بافتها و ارگانهای بدن با یکدیگر متفاوتند، چون مجموعه خاصی از ژنها در هر کدام بیان شده و از بیان دستهای دیگرممانعت به عمل آمده است. خاموش کردن اپیژنتیکی یکی از راههای خاموش کردن ژنها است و این به بیان افتراقی کمک میکند. این پدیده همچنین عدم همسانی کامل از لحاظ فنوتیپی دوقلوهای همسان را توضیح میدهد. بهعلاوه، اپیژنتیک در غیرفعال شدن کروموزوم X در پستانداران زن حیاتی است. در نتیجه این پدیده است که محصولات کروموزوم X در زنان دو برابر مردان نیست. پس، اهمیت خاموش کردن ژنها در اثر تغییرات اپیژنتیکی امری واضح است. در داخل سلولها سه سیستم در تعامل با یکدیگر این وظیفه را به انجام میرسانند: متیلاسیون DNA، تغییرات هیستون و خاموشسازی مرتبط با RNA.
متیلاسیون DNA
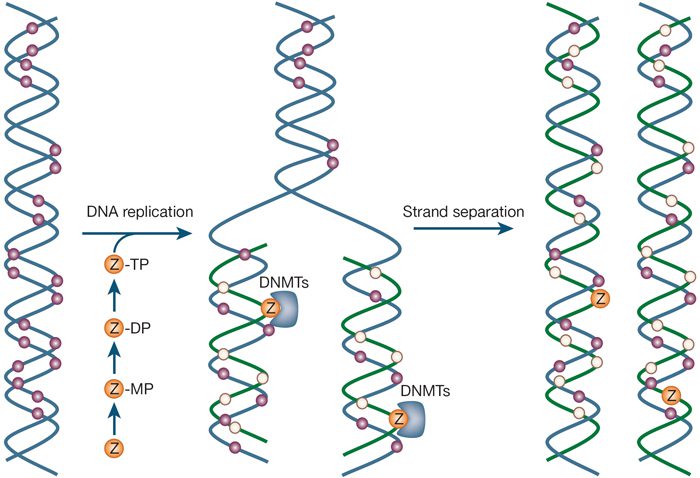
متلاسیون DNA فرایندی شیمیایی است که طی آن افزودن گروه متیل به DNA صورت میگیرد. این فرایند بسیار اختصاصی بوده و تنها در ناحیههایی صورت میگیرد که نوکلئوتید سیتوزین در مجاورت گوانین قرار گرفته است و با گروه فسفات به یکدیگر متصل شدهاند. این نقطه، جایگاه CpG نام دارد. جایگاههای CpG توسط یکی از سه آنزیمی که DNA متیل ترانسفراز (DMTها) نامیده میشوند. اتصال گروههای متیل، ظاهر DNA و ساختار آن را تغییر میدهد. درنتیجه ارتباط ژن با سیستم موجود در هسته که برای رونویسی موردنیاز است، تغییر مییابد. متیلاسیون DNA در برخی از ژنها به منظور تمایز کپیهای به ارث رسیده از پدر و مادر به کار میرود و به حکگذاری (imprinting) موسوم است.
ویرایش هیستون
هیستونها پروتئینهایی هستند که یکی از اجزاء اصلی کروماتین را تشکیل میدهند. کروماتین کمپلکسی از DNA و پروتئین است که کروموزمها را میسازد. هیستون به عنوان محوری عمل میکند که DNA میتواند حول آن بپیچد. ویرایش هیستونها پس از ترجمه آنها به پروتئینها رخ میدهد (post-translation modification) و میتواند نحوه آرایش کروماتین را تحت تاثیر قرار دهد. این موضوع رونویسی یا عدم رونویسی DNA مربوطه را تعیین میکند. در صورتیکه کروماتین در فرم فشرده خود نباشد، فعال است و DNA مربوطه میتواند رونویسی شود. در مقابل، در صورتیکه کروماتین فشرده باشد (و کمپلکسی به نام هتروکروماتین تشکیل دهد)، غیرفعال است و رونویسی DNA رخ نمیدهد.
دو راه اصلی به منظور ویرایش هیستون موجود است: استیلاسیون و متیلاسیون. این فرایندهای شیمیایی به ترتیب گروههای استیل و متیل را به آمینواسید لایزین موجود در هیستون متصل میکنند. استیلاسیون معمولا به کروماتین فعال مربوط است و داستیلاسیون به هتروکروماتین. به علاوه، متیلاسیون هیستون میتواند مارکری برای هر دو هر دو ناحیه فعال و غیرفعال کروماتین فراهم آورد. مثلا، متیلاسیون لایزین خاصی (K9) در هیستون خاصی (H3) در سراسر هتروکروماتین پخش شده و DNA خاموش را نشانهگذاری میکند. این نوعی از تغییر اپیژنتیکی است که باعث ایجاد کروموزوم X غیرفعال زنان میشود. در مقابل، متیلاسیون K4 روی H3 مارکر ژنی فعال است.
خاموشکردن مرتبط با RNA
ژنها میتوانند توسط RNA نیز خاموش شوند و این در حالتی اتفاق میافتد که RNA در فرم رونوشت آنتیسنس، RNA غیرکدکننده و RNA مداخلهگر باشد. RNA ممکن است بیان ژن را با تشکیل هتروکروماتین و یا با تحریک ویرایش هیستون و متیلاسیون DNA تحت تاثیر قرار دهد.
اپی ژنتیک و بیماری ها: تعدادی مثال
تغییرات اپی ژنتیکی در رشد نرمال و سلامتی حیاتی هستند، اما میتوانند عامل برخی از بیماریها نیز باشند. اختلال در هر یک از این سه سیستم توضیحدادهشده که منجر به تغییرات اپیژنتیکی میشود، میتواند منجر به فعالسازی غییرطبیعی و یا خاموشسازی ژنها شود. چنین اختلالاتی با سرطان، سندرومهای مرتبط با ناپایداریهای کروموزومی و عقبماندگی ذهنی در ارتباط باشند.
اپیژنتیک و سرطان
در سال ۱۹۸۳، سرطان به عنوان نخستین بیماری مرتبط با اپی ژنتیک شناخته شد. محققان دریافتند که بافت بیمار در افراد مبتلا به سرطان کولورکتال، دارای متیلاسیون DNA کمتری از بافت نرمال در همان بیماران بود. از آنجایی که ژنهای متیلهشده معمولا خاموش میشوند، از دست رفتن متیلاسیون یک ژن میتواند با تغییر آرایش کروماتین باعث فعالسازی بیش از حد آن شود. از سوی دیگر، متیلاسیون بیش از حد میتواند تاثیر محافظتی ژنهای سرکوبکننده تومور را معکوس کند.
همانطور که قبلا ذکر شد،متیلاسیون DNA در جایگاههای CpG انجام میشود و اکثر سیتوزینهای CpG در پستانداران متیله هستند. با این حال، در نزدیکی نواحی پروموتر تراکم بالاتری از جایگاههای CpG وجود دارد که به جزایر CpG موسومند و در سلولهای نرمال فاقد متیلاسیون هستند. این جزایر، در سلولهای سرطانی به میزان زیادی متیله میشوند و درنتیجه ژنهایی که نباید خاموش شوند، خاموش میشوند. این ناهنجاری، تغییر اپیژنتیکی تیپیکی است که در تومورها رخ میدهد و در اوایل رشد سرطان ایجاد میشود. هایپرمتیلاسیون جزایر CpG میتواند باعث خاموش شدن ژنهای سرکوبکننده تومور شود. در واقع احتمالا چنین تغییراتی در سرطانهای انسانی بیشتر از جهشهای توالی DNA رخ دهند.
به علاوه، با اینکه تغییرات اپی ژنتیکی توالی DNA را تغییر نمیدهند، میتوانند جهشها را باعث شوند. حدودا نیمی از ژنهایی که انواع ارثی و خانوادگی سرطان را باعث میشوند، توسط متیلاسیون خاموش میشوند. بسیاری از این ژنها، در حالت عادی تشکیل تومورها را مهار کرده و در ترمیم DNA نقش دارند و O۶-methylguanine-DNA methyltransferase (MGMT)، MLH1، cyclin-dependent kinase inhibitor 2B (CDKN2B) و RASSF1A از جمله آنها میباشند. به عنوان مثال، هایپرمتیلاسیون پروموتر MGMT باعث افزایش جهشهای G به A میشود. هایپرمتیلاسیون همچنین میتواند باعث ناپایداری میکروستلایتها شود که توالیهای تکراری از DNA هستند. میکروستلایتها در افراد سالم شایع بوده و بیشتر شامل تکرارهای دینوکلئوتیدی CA هستند. متیلاسیون بیش از حد پروموتر ژن ترمیم کننده DNA که MLH1 نام دارد، باعث ناپایداری میکروستلایت و درنتیجه کوتاهتر و یا بلندتر شدن آن میشود. ناپایداری میکروستلایت با سرطانهای بسیاری ارتباط داده شده است، از جمله سرطانهای کولورکتال، اندومتریال، تخمدان و معده.
اپی ژنتیک و عقب ماندگی ذهنی
سندروم X شکننده شایعترین علت عقبماندگی ذهنی ارثی است و خصوصا در مردان رخ میدهد. هر دو جنس میتوانند درگیر این اختلال شوند، اما از آنجایی که مردان تنها یک کروموزوم X دارند، وجود تنها یک X شکننده آنها را به نحو شدیدتری تحت تاثیر قرار خواهد داد. سندروم X شکننده تقریبا در یک نفر از هر ۴۰۰۰ مرد و یک نفر از هر ۸۰۰۰ زن رخ میدهد. افراد مبتلا به این سندروم دارای ناتوانی شدید ذهنی، تاخیر در رشد کلامی و رفتار شبه اوتیسمی هستند.
سندروم X شکننده نام خود را از شکل بخشی از کروموزوم X میگیرد که به علت ناهنجاری زیر میکروسکوپ آن گونه دیده میشود؛ به نحوی که به نظر میرسد توسط ریسمانی شکننده از کرموزوم آویزان میباشد. این سندروم به علت ناهنجاری در ژن FMR1 (fragile X mental retardation 1) حاصل میشود. افراد سالم از لحاظ سندروم X شکننده دارای ۶ تا ۵۰ تکرار CGG در ژن FMR1 خود میباشند. افراد با تعداد تکرارهای بالای ۲۰۰ جهش کامل را دارند و معمولا علائم بیماری را نشان میدهند. تعداد بسیار بالای CGG ها در جزایر CpG موجود در ناحیه پروموتر ژن FMR1 باعث متیلاسیون این ناحیه میشود، در حالی که در شرایط عادی متیله نیست. این متیلاسیون ژن را خاموش کرده و در نتیجه محصول آن که پروتئین عقب ماندگی ذهنی X شکننده نام دارد، تولید نمیشود. از دست رفتن این پروتئین به خصوص باعث سندروم X شکننده میگردد. با وجود اینکه تمام توجهها روی جهش گسترش CGG به عنوان عامل سندروم X شکننده است، تغییرات اپیژنتیکی مربوط به متیلاسیون FMR1 در واقع نقص اصلی است.
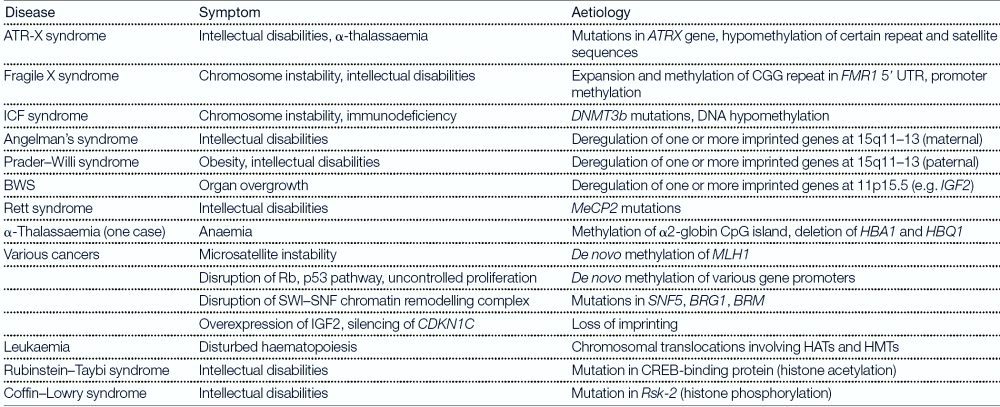
سندروم X شکننده تنها اختلال عقبماندگی ذهنی مرتبط با تغییرات اپی ژنتیک نیست و بیماریهای دیگری چون Rubenstein-Taybi، Coffin-Lowry، Prader-Willi، Angelman، Beckwith-Wiedemann، ATR-X و سندروم Rett نیز در این دسته قرار دارند (جدول ۱).
درمان بیماریها با اپی ژنتیک درمانی
از آنجایی که تغییرات اپی ژنتیکی در بیماریهای فراوانی مانند سرطان دارای نقش است، منطقی است که این تغییرات را با درمانهای اپی ژنتیکی اصلاح کنیم. از آنجایی که اپی ژنتیک، بر خلاف جهشهای توالی DNA طبیعتا برگشتپذیر است، این تغییرات اهداف درمانی ایدهآلی هستند. هدف پرطرفدارترین این درمانها، تغییر متیلاسیون DNA و یا استیلاسیون هیستون است.
مهارکنندههای متیلاسیون DNA میتوانند ژنهایی را که را که خاموش شدهآند، مجددا فعال نمایند. دو نمونه از این داروها عبارتند از: ۵-azacytidine و ۵-aza-2′-deoxycytidine. این اصلاحات مانند نوکلئوتید سیتوزین عمل میکنند و حین تکثیر خود را به ساختار DNA الحاق میکنند. پس از ورود به ساختار، دارو آنزیمهای DNMT را از فعالیت باز میدارد و متیلاسیون DNA مهار میشود.
داروهایی که تغییرات هیستون را هدف قرار میدهند، مهارکنندههای هیستون داستیلاز (HDACi) نام دارند. HDACها آنزیمهایی هستند که گروه استیل را از روی DNA برمیدارند. این امر منجر به فشردهسازی کروماتین و توقف رونویسی میگردد. توقف این فرایند با مهار HDACها بیان ژن را روشن میکند. معمولترین مهارکنندهها HDAC عبارتند از phenylbutyric acid، SAHA، depsipeptide، valproic acid.
احتیاط در اپیژنتیک درمانی ضروری است، چون پروسهها و تغییرات اپیژنتیکی در بدن بسیار فراگیر هستند. برای اینکه این درمانها موفق باشند، به منظور موفقیت، این درمانها باید انتخابی سلولهای غیرعادی باشند. در غیر این صورت، فعال کردن رونویسی ژن در سلولهای نرمال میتواند آنها را سرطانی کند. در نتیجه درمان خود عامل بیماریای میشود که قصد درمان آن را داریم. علی رغم این نقایص احتمالی، محققان به دنبال راههایی هستند که سلولهای غیرعادی را به صورت اختصاصی هدف قرار داده و کمترین آسیب به سلولهای نرمال وارد شود.
