فیزیولوژی موجودات زنده از جمله انسان تناوبهای زیادی را در ثانیه، ساعت، روز و ماه تجربه میکند. در حقیقت این تناوبها هستند که به حیات، پویایی میبخشند؛ و شاید یکی از مهمترینِ آنها ریتمهای گرهخورده با روز و شب باشد. چه بسا روزی دریابیم بخش اعظم پویایی ما در گرو نوریست که از محیط اطرافمان دریافت میکنیم. در این فصل روایتی جذاب از تحقیقات صورت گرفته بر روی ریتمهای شبانهروزی موجودات پست و بسط آن به سایر گونهها، از جمله انسان، را خواهیم خواند.
در سال ۲۰۱۷ انجمن نوبل، جایزهی بخش فیزیولوژی و پزشکی را به سه تن از دانشمندان برجستهی آمریکایی برای بیش از سه دهه فعالیت در حوزهی شناخت مولکولی ریتمهای شبانهروزی اختصاص داد. از میان این سه دانشمند، مایکل یانگ (Michael W. Young) مستقلاً، و جفری هال (Jeffrey C. Hall) و مایکل رزبش (Michael Rosbash) با همکاری نزدیکتری، به یافتههایی همگرا در خصوص شناخت مولکولی ساعت درونی موجودات زنده دست یافته بودند. در این پروسه دانشمندان بزرگ دیگری نیز تأثیرات عمیقی داشتهاند.

سیمور بنزر؛ الهامبخش بزرگ
سیمور بنزر (Seymour Benzer) فیزیکدان و بیولوژیستی بود که حوزهی نوظهور ژنتیک مولکولی را دنیای علم معرفی نمود. او اعتقاد داشت ژنها کنترلکنندهی رفتار هستند؛ این عقیده در آن روزها بسیار عجیب بود. اما بنزر با معرفی جهشهایی که موجب تغییرات رفتاری میشدند توانست ارتباط میان ژنهای بخصوص و رفتارهای تحت کنترل آنها را مطرح نماید.
وی برای بررسی موارد گفته شده انتخاب هوشمندانهی مگس سرکه (Drosophila melanogaster) را انجام داد. از جمله علل انتخاب مگس سرکه توسط بنزر بررسیهای فراوان صورت گفته توسط دانشمندان دیگر بر روی این جاندار بود. دورهی کوتاه زندگی مگس سرکه و موالید بسیار زیاد آن نیز در انتخاب این مدل حیوانی بیتأثیر نبودند.
با این وجود، علت اصلی انتخاب دروزوفیلا به عنوان مدلی برای مطالعات ارتباط ژن و رفتار، بر پایه اعتقاد بنزر به این بود که فرگشت و ابزار آن، یعنی انتخاب طبیعی، ذاتاً حفظکننده هستند. این بدان معناست که اولویت فرگشت، انتخاب ژنهای موجود در خزانهی ژنی است؛ تا ساخت انواع جدید آن. بهطور مثال، ژنی که توانایی کنترل تناوب روز و شب در مگس سرکه را داراست، آنالوگی در حیوانات عالیتر، از جمله انسان، را نیز خواهد داشت. اینگونه بود که حوزهی ژنتیک رفتاری شکل گرفت.
بنزر و دانشجویش، ران کونوپکا (Ron Konopka) در سال ۱۹۷۱ موفق به انتشار مقالهای در ارتباط با اولین ژن مرتبط با ریتمهای شبانهروزی و انواع جهشیافتهی آن در مگسهای سرکه شدند. آنها این ژن را «period» نامگذاری کردند. مطالعهی این دو دانشمند یکی از برترین پژوهشهای صورت گرفته در حوزهی ژنهایی بود که در رفتار تأثیر دارند.
در سال ۱۹۹۲ بنزر با همکاری مایکل روزبش – یکی از برندگان جایزهی نوبل سال ۲۰۱۷ – موفق به کشف این موضوع شدند که پروتئین کد شده توسط ژن period، که با نام PER شناخته میشود، پس از ترجمه وارد هسته سلولهای عصبی مگس سرکه میگردد. فعالیت این دو دانشمند بر روی ژن period و انواع جهشیافتهی آن همچون کاتالیستی، مطالعات سایر پژوهشگران در این زمینه را تسریع کرد. تا جایی که گمان میرفت بنزر موفق به دریافت جایزهی نوبل خواهد شد. اما وی در سال ۲۰۰۷ در سن ۸۶ سالگی درگذشت. کونوپکا نیز که نقش بسیاری در یافتههای بنزر داشت در سال ۲۰۱۵ از دنیا رفت.
جفری هال – دیگر دریافتکننده جایزه نوبل ۲۰۱۷ – همکاری فراوانی با رزبش در بررسی ژن period مگس سرکه داشت. کارهای اولیهی او نشان داده بود که این ژن تأثیر بسیار مهمی در تنظیم ریتم دورههای آواز معاشقه در مگس سرکهی نر دارد. این موضوع که period، تنظیم کننده ریتم است بدان معنا بود که این ژن نوعی عملکرد تشخیص زمان یا توانایی زمانشناسی را داراست. زمان زیادی سپری نشد تا جفری هال و مایکل رزبش با همکاری ثمربخش خود، توانستند ژن period که توسط بنزر در سال ۱۹۷۱ کشف شده بود را جداسازی کنند.
حال نوبت به شناسایی پروتئینهای مسئول رسیده بود. چرا که DNA صرفاً لیستی از دستورالعملها بوده و خود وارد عمل نمیشود. نوع دیگری از مادهی ژنتیک، موسوم به RNA، که رونوشتی از دستورات DNA است، باید در جایی دیگر ترجمه شود تا پروتئینها را ایجاد کند. جداسازی period به هال و رزبش این اجازه را داد تا پروتئینی که توسط این ژن کد میشود را شناسایی کنند. این پروتئین PER نامیده شد؛ اما این تنها قدم نخست بود.
رزبش و هال در ادامهی تحقیقات خود دریافتند که مقدار این پروتئین در سلولهای مگس سرکه با گذر زمان و بر اساس نور دریافتی جانور، دستخوش نوساناتی میشود. در حقیقت نتایج بررسیها نشان میداد غلظت این پروتئین در شب افزایش یافته و در طول روز کاهش مییابد. این تغییرات، تنظیمگر غلظت mRNAای هستند که رونوشت ژن period است. یافتهها نشان از وجود سازوکاری مشابه با چرخدندههای یک ساعت بود، اما جزئیاتی دربارهی مکانیسم دقیق ایجاد این نوسانات ارائه نمیداد.
پیشتر، یافتههای بنزر و رزبش نشان داده بود که مکان پروتئین PER در هستهی سلولها است؛ این در حالیست که میدانیم مکان تولید پروتئینها، سیتوپلاسم سلولهای یوکاریوتی است. چگونه این پروتئین پس از ساخته شدن در سیتوپلاسم وارد هسته میشود؟ آیا این اتفاق ارتباطی با مکانیسم نوسانات پروتئین PER دارد؟
یافتن حلقه مفقوده
مایکل یانگ به عنوان یکی دیگر از برندگان جایزهی نوبل فیزیولوژی و پزشکی در سال ۲۰۱۷، مستقلاً در دانشگاه راکفلر نیویورک بر روی ژن period و ریتم شبانهروزی دروزوفیلا کار میکرد. او و گروه تحقیقاتیاش، موفق به تشریح این موضوع که چگونه پروتئین PER پس از تولیدش در سیتوپلاسم مجدداً به هسته بازمیگردد، شدند. در سال ۱۹۹۴، نتایج تحقیقات یانگ در ژورنال ساینس (Science) با موضوع کشف ژن timeless منتشر شد. این ژن پروتئینی را با نام TIM، که سه حرف اول نام ژن است، کد میکند. پروتئین TIM پس از سنتر در سیتوپلاسم به PER متصل شده و آن را به داخل هسته منتقل میکند. پس از ورود PER به هسته، فعالیت تولید رونوشت و بیان ژن period تحت کنترل قرار میگیرد. در نتیجه با سیستمی روبهرو هستیم که با مکانیسم فیدبک منفی فعالیت خودش را تنظیم میکند. به بیانی دیگر، در صورت ساخته شدن بیش از حد PER، تایملسهای موجود اشباع شده و PER تجمعیافته در سلول موجب خاموشسازی ژن period میشود.
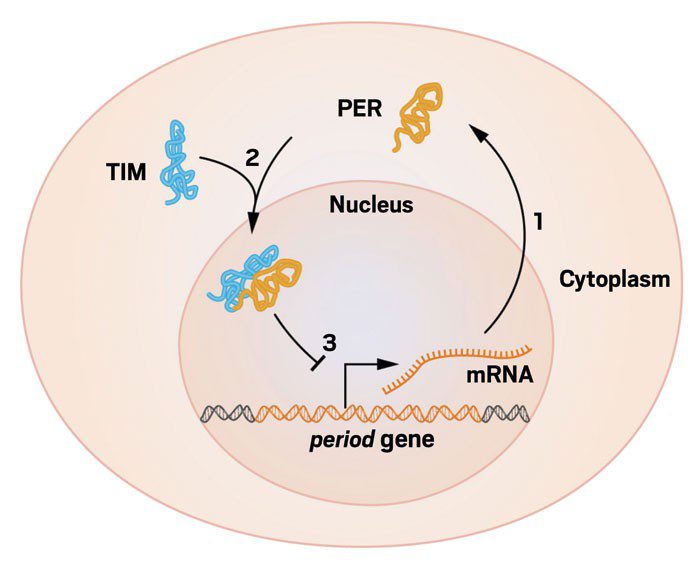
بهطور خلاصه ریتم شبانهروزی در مگس سرکه را میتوان اینگونه توضیح داد که وقتی مگسی در معرض نور قرار میگیرد، کمپلکسهای مولکولی PER و TIM در سلولهای مغز شروع به تجزیه شدن میکنند. کمپلکسهای PER/TIM قسمتی از حلقهای فیدبکی هستند که فعالیت ژنهای PER و TIM را تحت کنترل دارند. این ژنها ساختارهای لازم جهت ساخت پروتئینهای PER و TIM را در اختیار دارند.
سپس با رسیدن به میانه روز، هر میزان پروتئین PER و TIM که وجود داشت، تخریب میشود. دو پروتئین دیگر با نامهای CYCLE و CLOCK به یکدیگر متصل شده و کمپلکسهایی را شکل میدهند که به ژنهای PER و TIM روی DNA اتصال پیدا کرده و بهعنوان عوامل رونویسی، آنها را روشن میکنند. با فعال شدن این ژنها، mRNAهای مربوطه راهی سیتوپلاسم میشوند. در سیتوپلاسم، ریبوزومها که کارخانههای پروتئینسازی سلول هستند به ترجمهی mRNAها مشغول میشوند. به این ترتیب دوباره پروتئینهای PER و TIM به همدیگر چسبیده و کمپلکسهای PER/TIM جدیدی را هنگام غروب آفتاب شکل میدهند. در هنگام شب، کمپلکسهای جدید PER/TIM به هسته منتقل میشوند؛ جایی که قرار است فعالیت CYCLE و CLOCK را بلوک کنند. ضرورتاً با این کار تولید خود این پروتئینها هم خاموش میشود. با طلوع خورشید فردا، کمپلکسهای PER/TIM تجزیه شده و چرخه دوباره تکرار میگردد. همانطور که بنزر اعتقاد داشت این یافتههای بسیار با ارزش، اساس مولکولی ریتم شبانهروزی را در اغلب ارگانیسمهای زنده، از جمله گیاهان و انسانها، آشکار ساخته است.
چرا این یافتهها اهمیت دارند؟
یکی از واضحترین دلایل اهمیت این یافتهها، ارتباط آن با مکانیسم خواب و بیداری و بررسی ناهنجاریهای مرتبط با آن است. بیخوابیها تأثیر عمدهای در زندگی امروز جوامع بشری دارند؛ از سویی دیگر تحقیقات دانشمندان نشان از تأثیر خواب و ریتم آن در روند پیری دارد. لذا اکتشاف مسیرهای ایجاد ریتمهای شبانهروزی و شناخت آسیبهای آن کمک بسزایی در حل مشکلات مطرح شده خواهد کرد.
نوروبیولوژیستها زمان زیادیست که اعتقاد دارند، خواب، جهت مستحکمسازی حافظه ضروری است. تقریباً تمامی افراد در سنین بالا مقادیری از کاهش حافظه را تجربه میکنند؛ اما افرادی نیز مورد شناسایی قرار گرفتهاند که با وجود عمر بالا، با حافظهی بسیار قدرتمند شناخته میشوند. کشف ژنهای اصلی ریتمهای شبانهروزی از جمله per و timeless، مسیری تازه در بررسی این پدیدهها گشوده است. اهمیت دیگر یافتههای ریتم شبانهروزی در اثربخشی داروهاست. تحقیقات فراوانی نشان دادهاند که زمان مصرف داروها در آثار جانبی و اثربخشی درمانی آنها تأثیر بسزایی دارد. فیلد کرونوتراپی (chronotherapy)، که به درمان بیماریها بر اساس ریتمهای درونی بدن تمرکز دارد، با توجه به پیشرفتهای صورت گرفته در شناخت سیکلهای درونی بدن، جنبشی عمیق در خود دیده است. به درستی که جایزهی نوبل سال ۲۰۱۷ به افراد شایستهای تعلق گرفته است.
