محققان جانز هاپکینز، پس از استفاده از یک ابزار برشزنی به نام CRISPR، یک مجموعه قواعد کارآمد هم برای معرفی توالیهای DNAهای جدید به سلولها تنظیم نمودند. آنها میگویند که این روش که بر اساس آزمایشهای صورت گرفته روی جنین موشها و هزاران سلول انسانی انجام شده و میتواند هماهنگی و کارایی ویرایش جنان را بهبود ببخشد.
این روش جدید و پیشرفتهای مربوط به آن به صورت آنلاین در تاریخ ۲۸ام نوامبر در ژورنال Proceeding of the National Academy of Science انتشار یافت.
CRISPR ابزاری برای کمک به دانشمندان در اصلاح ژنوم، پیشبینی نتیجۀ صفات خاص و مطالعۀ آنها است. ولی این ابزار به خودی خود فقط شکستگی را در ژنوم ایجاد کرده و نمیتواند کنترل کند که چگونه یک توالی جدید از DNA وارد ژنوم میشود.
جرالدین سیدو (Geraldin Seydoux)، استاد گروه زیست مولکولی و ژنتیک پزشکی مرکز تحقیقات هانتینگتون شلدون، معاون تحقیقاتی دانشکدۀ پزشکی جانز هاپکینز و و محقق انیستیتو پزشکی هاوارد هیوز توضیح میدهد:
ما روی این مسئله مطالعه کردیم که چگونه سلولها شروع به ترمیم آن دسته از شکستگیهای DNA میکنند که توسط CRISPR ایجاد شده، و هدفمان استفاده از روند ترمیم DNA طبیعی سلولها برای نشان دادن توالی جدید در ژنوم بود. ما دریافتیم که سلولها به آسانی توالیها را از DNA خارجی برای ترمیم DNA شکسته شده کپی میکنند، البته تا زمانی که DNA خارجی به صورت خطی باشد.
با مطالعۀ این که چگونه قطعه DNA خارجی در طول فرآیند ترمیم کپی میشود، تعدادی قوانین ساده جهت انجام موثرتر اصلاح ژنتیک و بهینهسازی ابزار در دسترس، تنظیم نمودیم.
ابزار CRISPR، که اساس آن “تکرارهای پالیندرومی کوتاه با فواصل منظم” است ( ردیفهای پالیندورمی به ردیفهایی گفته میشود که حول یک محور فرضی به صورت متقارن قرار گرفته باشد) در پنج سال گذشته در میان دانشمندان به عنوان ابزاری که به صورت موثر DNA را برش میدهد، شهرتی جهانی کسب کرده است.
مقالۀ مرتبط: تماشا کنید؛ این بار ویرایش ژنی CRISPR را با چشم خودتان ببینید
این ابزار از یک فرایند دفاعی طبیعی در سلولهای باکتریایی که شامل ایجاد برش های کشنده در DNA ویروسی می باشد، به منظور استفاده در سلولهای پستانداران اقتباس شده است. اساساً این ابزار ساده شدأ مجموعهای از “قیچی های سلولی” میباشد.
اعتقاد غالب در میان دانشمندان این است که سلولها شکستگی DNA را، با قرار دادن تصادفی مجموعهای از نوکلئوتیدها، زیرواحدهای سازندۀ DNA، ترمیم میکنند. و این معمولاً هر ژنی را، در نقطهای که DNA شکسته شده را از بین میبرد.
همچنین این موضوع به خوبی برای دانشمندان شناخته شده که گاهی سلولها از منابع متفاوتی استفاده میکنند – دنبالهای از یک قطعه DNA دیگر یا “DNAی اهدا کننده” – که برای جوش دادن شکستگیهای DNA به کار گرفته میشود. اما، توالی “اهدا کننده” نمیتواند به خودی خود در فضای خالی موجود در ژنوم قرار بگیرد؛ بلکه نیازمند به یک نوع نوار (انتهای چسبناک) در هر انتها جهت قرارگیری در داخل شکاف حاصل از برش میباشد. دانشمندان این نوار هارا تحت عنوان یازوهای همسان DNA اهدا کننده میشناسند.
بازوهای همسان یا همگرا، شامل نوکلئوتیدهایی هستند که پروتئینهای سالم DNA را که با کدهای ژنتیکی تطبیق پیدا میکنند را میپوشاند. این موضوع به DNAی اهدا کننده کمک میکند تا به DNAی سالم بچسبد.
با این حال دانشمندان به DNAی اهدا کننده، به عنوان یک روش ناکارآمد برای ترمیم ژنوم مینگریستند. آنان این فرض را داشتند که این موضوع نیاز به بازوهای همسان بلندی داشته باشد، به خصوص وقتی که جایگزینی در یک توالی طولانی DNA انجام میشود و یا DNA تکرشتهای و یا حلقوی است، که آمادهسازیشان در طولهای بزرگ دشوار است.
همچنان که دانشمندان تجربیات بیشتری در زمینۀ CRISPR به دست میآوردند “سوالات پیرامون قوانین بهینۀ لازم برای طراحی DNAی اهدا کننده و طول بازو های همسان نیز بیشتر شد”.
به دنبال پاسخهایی برای این سوالات، محققان جانز هاپکینز ترکیبات متفاوتی از DNA را در سلولهای کلیوی جنین انسان، که به خاطر توانایی رشد مناسبشان و استفاده مکرر در تحقیقات سرطان شناخته شده است، قرار دادند.
مقالۀ مرتبط: ۱۰ دستاورد شگفتانگیز ویرایش ژن CRISPR طی چند سال گذشته
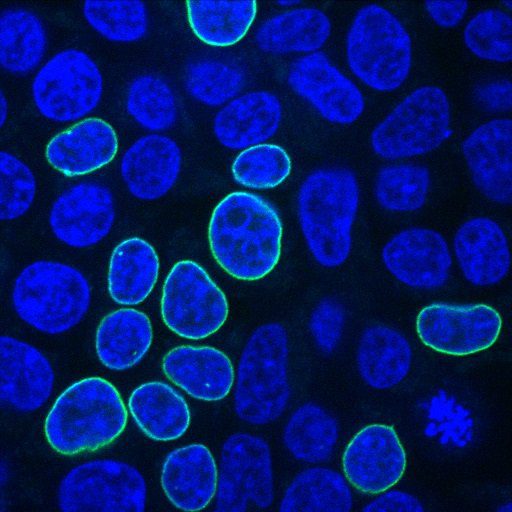
پژوهشگران از DNA اهدا کنندۀ حاوی ژن کدکنندۀ نوعی پروتئین فلوئورسنت بهره گرفتند. در صورتی که الحاق ژنی موفقیتآمیز باشد، پروتئین مذکور در غشای هستۀ سلول به رنگ سبز در می آید.
معاون تحقیقاتی جان هاپکینز الکساندر پایکس (Alexandre Paix) معتقد است که قطعات DNAی خطی کارکرد خوبی به عنوان اهدا کننده داشته و در سلولهای انسانی ۲ تا ۵ برابر کارآمدتر از DNAی حلقوی (که به عنوان پلاسمیدها آنها را میشناسیم) هستند. پایکس، با اشاره به ابزار PCR؛ که برای تقویت DNAبه کار میرود، گفت:
نوع خطی DNA، خیلی راحت در آزمایشگاه با استفاده از روش PCR آماده می شود.
پایکس همچنین طول بازوهای مختلف همسان را آزمایش کرد و دریافت که نقطه بهینه و مطبوع برای بازوهای همگن حدود ۳۵ نوکلئوتید در طول است، که خیلی کوتاهتر از آنچه که دانشمندان به صورت معمول استفاده میکنند میباشد. وی همچنین متوجه شد که بازوهای همگن ۳۳ تا ۳۸ نوکلئوتیدی در طول، از آنهایی که دارای ۵۱۸ نوکلئوتید بودند موفقتر عمل کرده چیزی بین ۱۰ تا ۲۰ درصد ویرایشهای صورت گرفته به این روش تحت شرایط بهینه، موفقیتآمیز است. در مقابل؛ وقتی دانشمندان بازوهای همگن ۱۵ و ۱۶ نوکلئوتیدی را آزمایش کردند میزان موفقیت در جاینشینی به نصف کاهش پیدا کرد.
آنها این نتایج را در سه موقعیت مختلف در ژنوم انسانی تکرار کردند. و دریافتند که توالیهای تازه جایگزین شده، صرف نظر از بازوهای همگن؛ میتوانند طولی برابر با ۱۰۰۰ نوکلئوتید داشته باشند.
این تیم میزان موفقیتی بالغ بر ۱۰ تا ۵۰ درصد را با جایگزینی قطعاتی به طول ۵۷ تا ۹۹۳ نوکلئوتید به دست آورد. توالی های کوتاهتر، با درصد موفقیت بیشتری نسبت به انواع بلندتر جایگزین میشوند. مثلاً توالی جدیدی که ۵۷، ۷۱۴ و ۹۱۳ نوکلئوتید درازا داشتند به ترتیب: ۴۵/۵، ۲۳/۵ و ۱۷/۹ درصد از زمان با موفقیت جایگزین میشدند. قطعات بلندتر از ۱۰۰۰ نوکلئوتید؛ به طولهای ۱۱۲۲ و ۲۲۲۹ نوکلئوتید موفقیت کمی داشتند، چیزی حدود ۰/۵ درصد.
سیدو ادامه میدهد:
در این اندازه، ارائه مقدار کافی DNAی اهدا کنندهای که برای ویرایش مورد نیاز است بسیار مشکل میشود و سلول نمیتواند این حجم از DNA را تحمل کند.
در نهایت، گروه دریافت که میزان موفقیت حداکثر ویرایش هنگامی است که توالی جدید در ۳۰ نوکلئوتید از جایگاه برش CRISPR قراربگیرد.
سیدو افزود:
فراتر از ۳۰ نوکلئوتید، اصولا عملی نیست. این پارامترها باید با بیشتر ژنهایی که دانشمندان برای ویرایش آنها تلاش میکنند همساز باشد. در حقیقت بیشتر آزمایشها شامل ویرایش تنها دو یا سه نوکلئوتید نزدیک به محل برش CRISPR است.
پژوهشگران همچنین بررسی نمودندد که آیا این روش میتواند در جنین موش کارآمد باشد یا خیر. این آزمایش با استفاده از یک قطعهی PCR با بازوی همگن ۳۶ نوکلئوتیدی انجام شد.
گروه موفق به جایگزینی قطعۀ ۷۳۹ نوکلئوتیدی کدکنندۀ پروتئین فلوئورسنت در ۲۷ جنین موش (از مجموع ۸۷ تا) شد. تیم تحقیقاتی سیدو در حال حاضر از قواعد ترمیم برای مطالعه DNA در گونهای از کرمها به نام Caenorhabditis elegans استفاده میکند. آنها حال مطالعه این موضوع هستند که آیا قوانین ترمیم به سایر سلولهای انسانی نیز تعمیم داده میشود یا خیر.
