تشکیل و پایداری میکروبهای متصل به سطح، که به نام بیوفیلم شناخته میشوند، مسئول ۷۵درصد عفونتهای میکروبی انساناند. شیوه زندگی بیوفیلم مزایای متعددی به ویژه در طی روند جایگذاری تجهیزات پزشکی یا اعضای بدن، برای پاتوژنها دارند. علاوه براین، باکتریهای چسبیده در برابر استرسهای خارجی مانند عوامل ضدعفونی، تحمل بالایی دارند. بیوفیلمها جمعیتهای بسیار رقابتیاند و برخی میکروارگانیسمها ظرفیتهای ضد بیوفیلمی مانند: مهار رشد باکتری دارند.
محرومیت یا رقابت، آنها را قادر به بدست آوردن مزایا و غالب بودن میکند. رمزگشایی و کنترل خواص ضد بیوفیلم، چالشهایی برای کنترل عفونت انسانی را در آینده نشان میدهد.
معرفی
بیوفیلمها جوامع چندمیکروبیاند که در ماتریکس پلیمری که خودشان ساختهاند، محصور میشوند. آنها به سطوح زیستی یا غیرزیستی متصل میشوند. هشتاد درصد تودههای میکروبی جهان به حالت بیوفیلم دیده شدهاند. بنابراین سلولهای چسبیده به عنوان غالبترین حالت زندگی میکروارگانیسمها در طبیعتاند. این سلولها اغلب فنوتیپ متفاوت از همتایان پلانکتونیک غیرتابع خود دارند. همچنین ظرفیت بالای مهاجرت به سطح جدید و تحمل بالا در برابر استرس خارجی دارند. بیوفیلمها بسته به گونههای میکروبی و تمرکزشان در نقطه خاص ( محیط زیست/ زیست پزشکی/ صنعت) میتوانند برای انسان مفید یا مضر باشند. طبق آمار موسسات ملی بهداشت، بیش از ۷۵ درصد عفونتهای میکروبی که در بدن انسان رخ میدهد، در اثر تشکیل و پایداری بیوفیلمهاست. برخی بیوفیلمهای باکتریایی، مثل: فلور باکتریایی روده نقش محافظتی و عملکردی ایفا میکنند. هم سفرگی در روده و تعامل مفید باکتری با باکتری، مستقیما در هموستازی میزبان دخیلاند. در سلامت انسان، عدم تعادل فلور طبیعی، سوءزیست نامیده میشوند و با چندین بیماری مرتبطاند. این همبستگی بسته به تعامل باکتریها میان اعضای جوامع باکتری مانند اثر گروه، همکاری، رقابتهای جنسی، تجلی بیان ژنتیکی و تنوع فنوتیپی بوده و میتواند شامل صفت آنتی بیوفیلم شود. دخالت اثر تعامل، الگوهای آنتی بیوتیکی در مجادله با میکروارگانیسمهای پاتوژنیک را تحت تاثیر قرار میدهد. بسیاری عفونتهای مرتبط با دستگاههای پزشکی و عفونتهای مزمن را میتوان به میکروبهای مرتبط با بیوفیلم نسبت داد. برای مقابله با مسائل بهداشتی مرتبط با مشارکت بیوفیلمها در ايجاد عفونت، پیشنهاد شد پزشکان و کارکنان مراقبتهای بهداشتی در تشخیص و درمان آن دخالت بیشتری داشته باشند. همچنین علم کاربردی در زمینه تشکیل بیوفیلم و جلوگیری از آن برای تولید دانش بیشتر در رابطه با آلودگی دستگاههای پزشکی استفاده شود.
فعالیت ضد بیوفیلمی به چه معناست؟
بیوفیلمها در ابتدا به عنوان جوامع تشکیل یافته از سلولهای باکتریاییاند که در ماتریکس پلیمری ساخته خودشان محصور شدهاند و خواهان سطوح زنده یا بیجاناند. بعدها مشخص شد بیوفیلمها فنوتیپ تغییر یافتهای نسبت به سلولهای پلانکتونی مرتبط نشان میدهند، به ویژه با توجه به رونویسی ژن. بیوفیلمها همه جا حضور دارند و تقریبا همه گونههای میکروارگانیسمها، باکتریها، قارچها، مخمرها، جلبکها، پروتوزوئرها و ویروسها قادر به چسبیدن به سطوح و یا یکدیگرند تا ایجاد بیوفیلم کنند. بیوفیلمها توسط جامعه بهداشت عمومی به عنوان یک منبع مهم پاتوژنها شناخته شده است. آنها در بیماریهای عفونی خاص مانند: Peridontitis, otitis media, osteomyelitis و پوسیدگی دندان و بیماریهای مزمن مانند: عفونتهای ریوی سیستیک فیبروزیس ، درگیرند. آنها همچنین در عفونتهای بیمارستانی ناشی از پاتوژنهای فرصت طلب، بویژه دستگاه اداری، دستگاه تنفسی تحتانی، عفونتهای محل جراحی و باکتریایی، غالبا زمانی که زمانی که دستگاههای خارجی استفاده شده، حضور دارند. در سال ۲۰۱۲، بررسی شیوع ۱۹۳۸ مراکز مراقبت بهداشتی و ۳۰۰۳۳۰ بیمار درمان شده توسط انجمن فرانسوی RAISIN، نشان دادهاند که شایعترین میکروارگانیسمهای مرتبط با عفونتهای بیمارستانی اشریشیاکلای و استافیلوکوکوس اورئوس(با مقاومت ۳۸.۱% نسبت به متی سیلین)، سودوموناس اورژینوس و نومونیا بودهاند که همه آنها تولید کنندههای بالای بیوفیلماند.
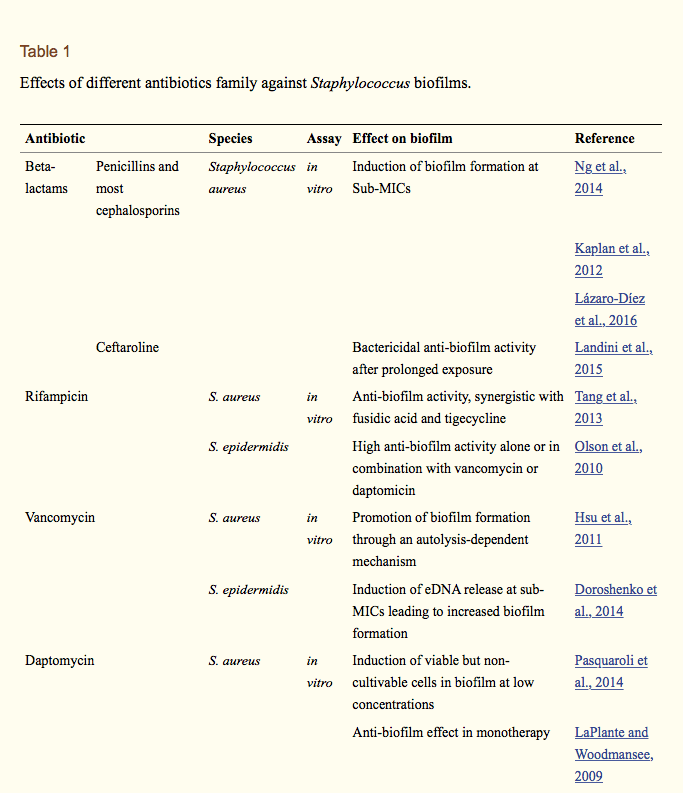
بیوفیلمها مشکلات بالقوهای را بوجود آوردهاند، زیرا سلولهای باکتریایی بیپایه به طور ذاتی بازدارانده عوامل ضد میکروبی مانند آنتی بیوتیکها هستند. عوامل متعددی مسئولیت مقاومت در برابر بیوفیلمها را دارند که از جمله آنها تراکم و وضعیت فیزیولوژیکی سلولها و همچنین ساختار فیزیکی بیوفیلم است. اگزوپلی ساکاریدها و DNAهای خارج سلولی ماتریکس بیوفیلم به عنوان مانعی برای انتشاراند، بدین ترتیب باعث کاهش نفوذ آنتی بیوتیکها به بیوفیلمها میشود. اثر بخشی این سدها بر آنتی بیوتیکها متفاوت است، تتراسایکلین، ریفامسین، فلوروکینونها و داپتومایسن بهتر از بتالاکتامازها، آمینوگلیکوزیدها و گلایسوپپتیدها است.
مقالات مرتبط: بیوفیلم چیست؟
مواد دندانی جدید در برابر پلاک مقاومت کرده و میکروبها را میکشد
آنتی بیوتیکها همچنین توسط اثرات محیطی خاص بر بیوفیلمها تاثیر میگذارند، مثل: PH اسیدی و سطح پایین اکسیژن در لایههای عمقی. سلولهای داخلی بیوفیلم معمولا کمتر از سلولهای پلانکتونی فعالاند و به همین دلیل نسبت به مکانیسم عمل بسیاری از آنتی بیوتیکها که سنتز ماکرومولکولها یا مسیرهای متابولیکی مانند بتالاکتامها و کینولونها را هدف قرار میدهند، حساس هستند. علاوه بر این، یک درصد از سلولهای موجود در بیوفیلم ممکن است سلولهای سمجی باشند، که بطور موقت آنتی بیوتیک را تحمل میکنند بدون اینکه تغییرات ژنتیکی مقاومت ضدمیکروبی در آنها دیده شود. حضور آنتی بیوتیکها به تنهایی باعث استقامت و یا افزایش تشکیل بیوفیلم، مخصوصا در غلظتهای مهاری کمینه (MIC) میشود که منجر به شکست درمان میشود. تشخیص آزمایشگاهی MICها منحصر به سلولهای پلانکتونی که به طور تصاعدی در شرایط بهینه برای عملکرد داروها، رشد میکنند است که در جمعیت بیوفیلمها بعید به نظر میرسد. آزمایشات in vivo (در داخل بدن) و in vitro (در آزمایشگاه)، نشان میدهند که MIC و حداقل غلظت باکتری (MBC) برای سلولهای بیوفیلمی باکتریایی معمولا بسیار بالاتر از سلولهای پلانکتونی همتا است. رسیدن به مقدار آنتی بیوتیک MBC برای ریشهکن کردن بیوفیلم در بدن موجود زنده، با دستورالعملهای آنتی بیوتیکی معمولی غیرممکن است. علت آن سمیت و عوارض جانبی آنتی بیوتیکها و محدودیت عملکرد کلیوی و کبدی است. ترکیب آنتی بیوتیکها با مکانیسمهای مختلف در کشتار، منجر به همکاری میشود که امروزه بهترین راهکار از بین بردن عفونت باکتریایی است. ترکیباتی از Rifampicin و fosfomycin، افزایش فعالیت علیه بیوفیلمهای استافیلوکوکوس اورئوسی در آزمایشگاه نشان دادهاند. اما اثربخشی آنها در داخل بدن موجود زنده ، هنوز مشخص نشدهاست.
علاوه بر اینها فنوتیپ بیوفیلم به ویژه، فاگوسیتوز لکوسیت، مقاومت به دفاع میزبان را نشان میدهد. راهکارهای مختلفی برای فرار بیوفیلم از سیستم ایمنی وجود دارد، که شامل: مهار جذب سلولهای بیوفیلم توسط فاگوسیتها و کمبود ایمونوژنیسیتهی ماتریکس بیوفیلم میشود. این خواص مقاومت و تنوع ژنتیکی و فنوتیپی سلول در بیوفیلم باعث میشود کسانی که در حیطه درمانهای مخصوص بیوفیلم فعالیت میکنند، این علت شایع مقاومت عفونت را ریشه کن کنند. براساس دانش فعلی، واژه “ضدبیوفیلم” را به معنی “ فرایندی طبیعی یا القا شده، که منجر به کاهش زیست توده باکتریایی از طریق تغییر شکل بیوفیلم، یکپارچگی و یا کیفیت آن است.”
طبق مطالعات، دو مکانیزم ضدبیوفیلمی متفاوت میتوانند شکل گیری بیوفیلم را تنظیم کنند: مهار چسبندگی سطح باکتریایی، بیوثبات کردن و شکستن بیوفیلمهایی که بصورت چسبیدهاند. بسیاری از عوامل ضدبیوفیلمی موجود، کشنده نیستند. اما برخی مولکولهای ضد باکتریایی میتوانند به عنوان عامل ضد بیوفیلم در نظر گرفته شوند؛ زیرا هنوز هم به دلیل نحوه معماریشان نسبت به بیوفیلمهای بالغ، محافظت میشوند. عوامل ضدبیوفیلمی، ضد باکتریایی، باید به طور خاص هدفمند باشند،در غیر اینصورت استفاده از آنها میتواند ترکیب اکوسیستمهای ایجاد شده را خنثی کند و میکروبیوتای مفید را نابود کند. عوامل ضدبیوفیلم ، به دو گروه بزرگ تقسیم میشوند: مصنوعی و طبیعی. مهارکنندههای بیوفیلمی مصنوعی که در جدول پایین آورده شده است؛ بیشتر از تکنولوژی ضد باکتریایی حاصل میشود.