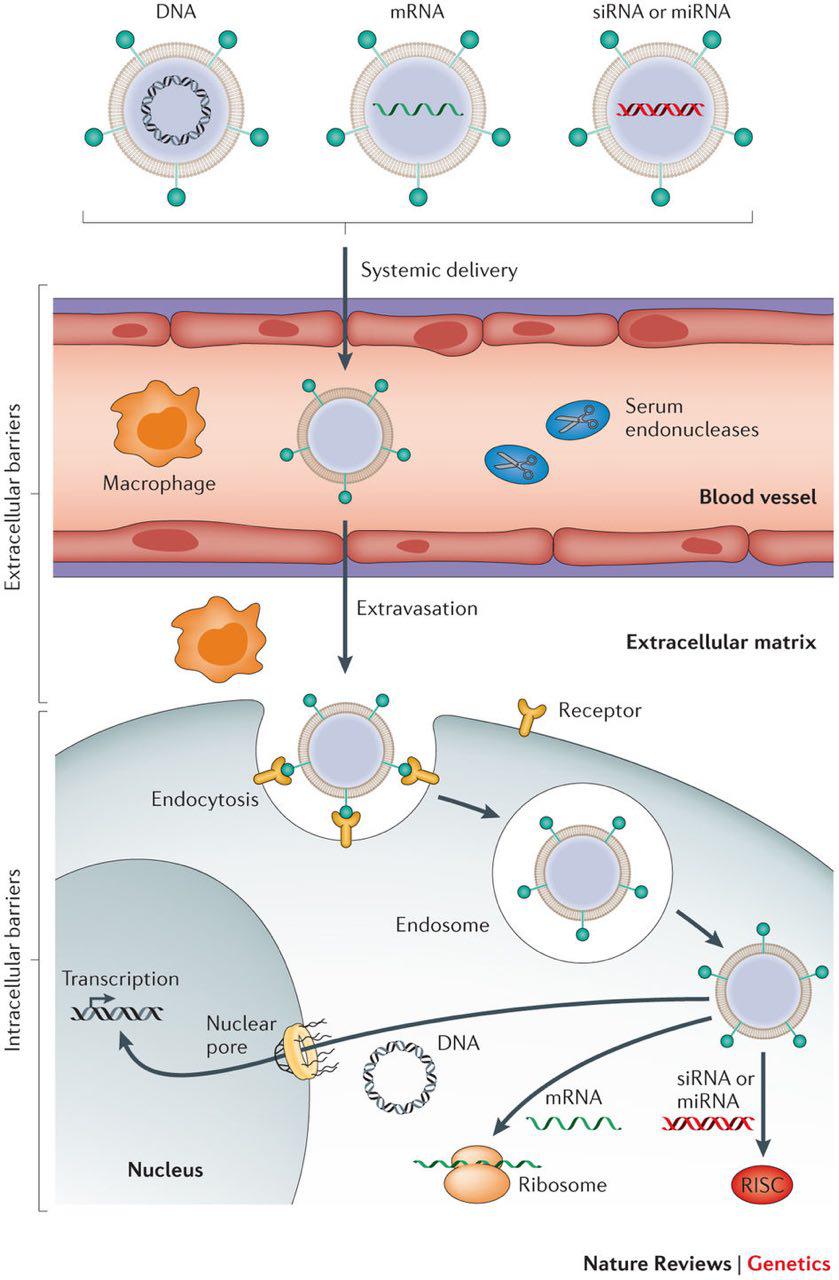
ویروسها به طور موثری ماده ژنتیکی را وارد سلولهای بیمار میکنند اما محدودیتهای نیز دارند. با استفاده از وکتورهای غیرویروسی میتوان به برخی از این محدودیتها غلبه کرد. استفاده از وکتورهای غیرویروسی مزایایی نسبت به وکتورهای ویروسی دارد، تولید وکتورها در مقیاس بزرگ و ایمونوژنسیتهی پایین تنها دو مورد از این مزیتهاست. میزان کم ترنسفیکشن و بیان ژن در وکتورهای غیرویروسی محدودیتی است که امروزه به کمک تکنیکهای ملکولی از بین رفته است.
مقاله مرتبط: انتقال ژن: وکتورهای ویروسی
تزریق DNA برهنه
این روش سادهترین روش آلوده کردن سلولها به کمک وکتورهای غیرویروسی است. کارآزماییهای بالینی در این زمینه همواره موفق بوده است اما با این وجود بیان ژن در این روش نسبت به سایر روشها کمتر است.
علاوه بر آزمایشهایی که از طریق پلازمیدها انجام شده است به کمک محصولات PCR برهنه نیز آزمایشهایی انجام گرفته است که به همان اندازه یا حتی بیشتر موفق بودند. به طور کلی احتمال جذب DNA برهنه توسط سلول بسیار کم است؛ بنابراین عمده تمرکز محققان تلاش برای افزایش جذب DNA برهنه میباشد. در نتیجهی تلاش محققان در این زمینه، روشهای متعددی از جمله الکتروپوریشن، سونوپوریشن و استفاده از تفنگ ژنی بوجود آمده است.
الکتروپوریشن
در روش الکتروپوریشن از پالسهای کوتاه ولتاژ بالا برای انتقال DNA از عرض غشایء سلولی استفاده میشود. این شوک الکتریکی به طور موقت حفرههایی را در غشاء سلول ایجاد میکند بدین ترتیب ملکول DNA قادر خوهاد بود از غشاء عبور کند. به طور کلی این روش بسیار کارآمد است و در گسترهی وسیعی از سلولها کاربرد دارد. با این وجود میزان بالای مرگ سلولی ناشی از الکتروپوریشن سبب ایجاد محدودیتهایی برای استفاده از آن شده است. اخیراً در آزمایشههای ژندرمانی روش جدیدی از الکتروپوریشن، که تحت عنوان ترانسفکشن بهمن الکترون شناخته میشود، استفاده میشود. در این روش با تخلیه پلاسما با ولتاژ بالا، به کمک پالسهای بسیار کوتاه (میکروثانیه) DNA منتقل میشود. در مقایسه با الکتروپوریشن این روش کارآمدتر بوده و آسیب سلولی کمتری را به دنبال دارد.
تفنگ ژنی
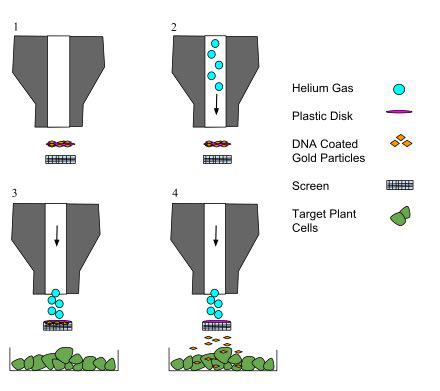
استفاده از بمباران ذرات یا همان تفنگ ژنی، یکی دیگر از روشهای فیزیکی ترانسفکشن DNA میباشد. در این روش DNA با ذراتی از طلا پوشیده شده و در داخل یک دستگاه بارگذاری میشود. این دستگاه با تولید نیرو سبب نفوذ DNA به داخل سلولها و جدا شدن ذرات طلا از آنها میشود. تفنگ ژنی پتانسیل بسیار بالایی دارد و میتواند برای تمامی سلولها مورد استفاده قرار گیرد، اما در حال حاضر تنها روی سلولهای گیاهی استفاده میشود.
سونوپوریشن
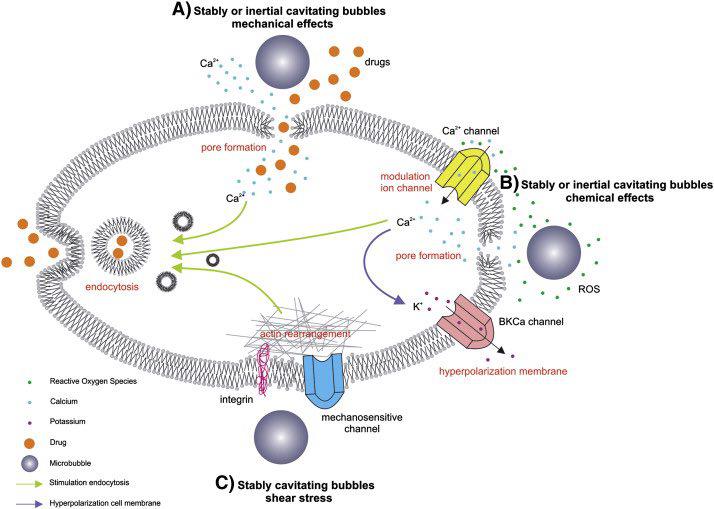
اولین از این روش برای انتقال داروی انسولین به سلولها استفاده شده است. در این روش از فرکانسهای اولتراسونیک برای انتقال DNA به داخل سلول استفاده میشود. حفرهسازی به کمک صدا غشاء سلول را تخریب میکند بدینترتیب DNA قادر خواهد بود از آن عبور کند. برای کنترل آستانه حفرهسازی از میکرو حبابها استفاده میشود. این میکروحبابها کرههایی با دیواره مستحکم هستند که با گاز پر شدهاند.
مگنتوفکشن
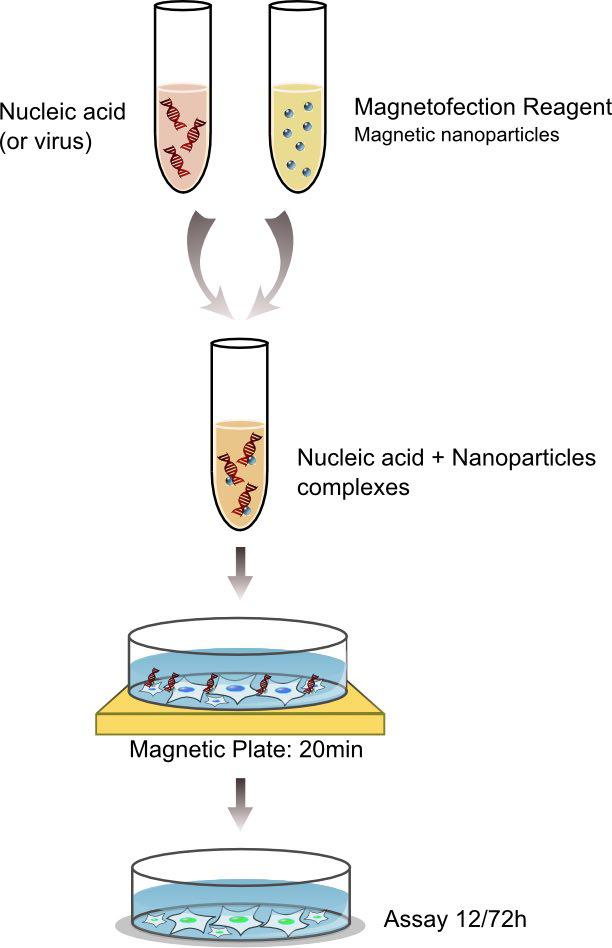
در روش مگنتوفکشن DNA با ذرات مغناطیسی ترکیب میشود سپس آهنربایی که زیر دیسک کشت بافت قرار میگیرد ترکیب DNA را با یک لایه سلولی در تماس قرار میدهد. این روش برای تمامی انواع نوکلئیک اسیدها (DNA، siRNA، dsRNA، mRNA، …) کاربرد دارد.
انتقال هیدرودینامیکی
در این روش حجم بالایی از محلول داخل عروق تزریق میشود بدین ترتیب نفوذپذیری اندوتلیوم و سلولهای پارانشیمی افزایش یافته و انتقال ملکولها به داخل سلول ممکن میشود. محلول شامل ملکولهایی مانند پلازمید DNA یا siRNA میباشد که با فشار هیدرواستاتیکی بالا به داخل سلول منتقل میشوند.
الیگونوکلئوتیدها
به کمک الیگونوکلئوتیدهای صناعی ژنهای مسبب بیماری غیرفعال میشوند. به طور عمده ۴ استراتژی برای استفاده ازالیگونوکلئوتیدها وجو دارد:
۱. استفاده از قطعات آنتی سنس علیه ژن بیماری زا به منظور تخریب رونویسی آن.
۲. استفاده از ملکولهای RNA کوچکی به نام RNA مداخله گر (siRNA)، این RNA توالی خاصی را در رونویس mRNA از ژن معیوب میشکند و بدین ترتیب مانع از بیان ژن معیوب میشود.
۳. در استراتژی سوم از اولیگونوکلئوتیدهایی دورشته ای به عنوان طعمه ای برای فاکتورهای رونویسی مورد نیاز برای رونویسی ژن هدف استفاده میکند. فاکتورهای رونویسی به تلههای پروموتور ژن معیوب متصل و رونویسی از ژن هدف که باعث بروز بیماری میشود را کاهش میدهند.
۴. DNA تک رشتهای نیز برای کنترل تغییر یک باز منفرد در داخل ژن جهش یافته استفاده میشود. الیگونوکلئوتید مکمل ژن هدف طراحی میشود (ژن هدف به عنوان قالبی برای ویرایش باز عمل میکند) با این تفاوت که فاقد باز منفرد مورد نظر خواهد بود.
لیپوپلکسها
یکی از لازمههای بهبود انتقال DNA جدید به داخل سلول، حفاظت DNA از صدمات و (بار مثبت) میباشد. بدین منظور در ابتدا، از چربیهای آنیونی و خنثی برای ساخت لیپوپلکسهایی با نقش وکتورهای مصنوعی استفاده میشدند. علیرغم سمیت کم و سازگاری بالای این ترکیبات با مایعات بدن، تولید آنها پیچیده و وقت گیر بوده و توجهات به سمت تولید نسخههای کاتیونی پیش رفت.
با توجه به بار مثبت لیپیدهای کاتیونی، از آنها اولین بار به منظور متراکم سازی مولکولهای DNA و برای تسهیل سازی کپسوله کردن آنها داخل لیپوزومها استفاده شد. اندکی بعد مشخص شد که استفاده از لیپیدهای کاتیونی به طور معناداری پایداری لیپوپلکسها را ارتقا میدهد همچنین با توجه به بار مثبت آنها لیپوزومهای کاتیونی با غشای سلولی تعامل میکنند. اعتقاد است که اندوسیتوز به طور گستردهای روش اصلی جذب لیپوپلکسها توسط سلول است. در نتیجهی اندوسیتوز، اندوزومها تشکیل میشوند و اگر ژنها نتوانند با شکستن دیواره اندوزوم وارد سیتوپلاسم شوند، اندوزوم با لیزوزوم ترکیب شده و محتوای داخلیاش از بین میرود. اگرچه لیپولکسهای کاتیونی به طور گسترده به عنوان وکتورهای انتقال ژن استفاده میشوند اما سمیت وابسته به دوز آنها نیز مشاهده شده است که استفادهی درمانی آنها را محدود میکند.
متداولترین استفاده از لیپوپلکسها در انتقال ژن به داخل سلولهای سرطانی میباشد. ژنهایی که منتقل میشوند ژنهای سرکوبگرِ تومور داخل سلولها را فعال میکنند و فعالیت انکوژنها را کاهش میدهند. مطالعات جدید نشان داده است استفاده از لیپولکسها برای ترنسفکشن سلولهای اپیتلیال تنفسی نیز کارآمد میباشد.
پلیمرزومها
پلیمرزومها انواع سنتزی لیپوزومهای (حاملینی با یک لایه لیپیدی) ساخته شده از کوپلیمرهای آبدوست هستند که میتوانند هم محتوای آبدوست و هم آبگریز را کپسوله و برای تحویل بارهایی مانند DNA، پروتئین و داروها به سلولها استفاده شوند. مزیت آنها نسبت به لیپوزومها پایداری بالاتر، مقاومت مکانیکی و زمان گردش خون بالاتر و ظرفیت ذخیره بیشتر است.
پلی پلکسها
پلی پلکسها ترکیب پلیمر و DNA میباشند. اغلب پلی پلکسها حاوی پلیمرهای کاتیونی هستند و ساختار آنها براساس تقابلات یونی شکل میگیرد. یک تفاوت مهم بین این روش و لیپولکسها این است که پلی پلکسها نمیتوانند DNA خود را مستقیماً وارد سیتوپلاسم کنند در نتیجه انتقال همزمان عوامل تجزیه کننده اندوزوم مانند آدنوویروسهای غیرفعال نیاز است.
به دلیل سمیت پایین، ظرفیت بالای انتقال و ساختار ساده، نانو حاملهای پلی کاتیونی در مقایسه با وکتورهای ویروسی (که سبب پاسخ ایمنی شده و ریسک سرطانزایی دارند) و وکتورهای لیپیدی (که سمیت وابسته دوز دارند) کارآمدتر هستند. پلیمرها تنوع بالایی داشته و سهولت کنترل اندهزه، شکل و ساختار شیمیایی سطح این پلیمرها مزیت بالایی برای عملکرد اختصاصی آنهاست.
دندریمرها
یک دندریمر مولکولی پرشاخه با ساختاری کروی است که سطح ذرات آن ممکن است با استفاده از روشهای متعددی عامل دار شود. بسیاری از خواص ساختاری دندریمرها بوسیله سطح آنها تعیین میشود. با قرار دادن یک دندریمر کاتیونی که بار سطحی آن مثبت است در حضور ماده ژنتیکی مانند DNA و یا RNA که دارای بار منفی میباشند امکان پیوند موقت میان نوکلئیک اسید و دندریمر کانیونی بوجود میآید. سپس ترکیب دندریمر- نوکلئیک اسید از طریق آندوسیتوز وارد سلول هدف میشود.
به طور عمده از لیپیدهای کاتیونی به عنوان عامل ترنسفکشن استفاده میشود اما محدودیتهایی در استفاده از آنها وجود دارد؛ از جمله عدم توانایی انتقال به برخی از انواع سلولها، عدم سازگاری با مدلهای حیوانی و سمیت. در مقابل دندریمرها ساختارهای کوالان قدرتمندی را ایجاد میکنند و به کمک آنها امکان کنترل کامل روی ساختار و اندازه ملکول وجود دارد؛ بنابراین در مقایسه با لیپیدهای کاتیونی مزایای بیشتری دارند.
ساخت دندریمرها نیازمند واکنشهای متععد و آهسته است بنابراین فرایندی طولانی مدت و هزینه بر میباشد، محدودیتی که مانع از پیشرفت این رویکرد شده است. روش سینتیکی جدیدی برای ساخت دندریمرها طراحی شده است که نه تنها هزینهی تولید آن را تا سه برابر کاهش میدهد بلکه مدت زمان تولید نیز از یک ماه به چند روز تقلیل مییابد.
نانوذرات معدنی
نانوذراتی مانند طلا، طلا، سیلیکا، اکسیدآهن و کلسیم فسفات نیز میتوانند به عنوان وکتور مورد استفاده قرار گیرند. پایداری برای ذخیرهسازی ملکولها، هزینه و زمان کم ساخت، ایمنوژنسیتهی پایین و مقاومت در برابر تهاجمات میکروبی از جمله مزایای وکتورهای معدنی میباشد. ذرات نانو با اندازه کمتر ۱۰۰ نانومتر توانایی بالایی در به دام انداختن RNA یا DNA و فرار بدون آسیب از درون اندوزومها دارند. استفاده از کوانتوم داتها نیز موفقیتآمیز بوده است. کوانتوم داتها برای ترکیب ژندرمانی با مارکرهای فلورسانس بسیار کارآمد هستند.
دومینهای انتقال پپتیدی
این پپتیدهای نفوذ کننده به داخل سلول (CPPs) پپتیدهای کوتاهی هستند (کمتر از ۴۰ آمینواسید) که میتوانند به طور کوالان و یا غیرکوالان به ملکولها متصل شده و به راحتی از غشا سلول عبور کنند. به طور معمول ورود به سلول از طریق اندوسیتوز رخ میدهد اما مکانیسمهای دیگری نیز وجود دارد. به کمک این پپتیدها میتوان نوکلئیک اسیدها، لیپوزومها و داروهایی با وزن ملکولی پایین را به داخل سلول منتقل کرد.
با ترکیب توالیهای مکانیابی به داخل CPPها میتوان آنها را به طور مستقیم وارد ارگانل خاصی درون سلول کرد. معمولاً از این توالیها برای هدایت CPP حامل به داخل هسته استفاده میشود.
روشهای هیبریدی
هریک از روشهای انتقال ژن کاستیهای مربوط به خود را دارد، با ترکیب دو یا چند تکنیک مختلف میتوان بر این کاستیها غلبه کرد. برای مثال ویروزمها که برای انتقال به سلولهای اپیتلیال تنفسی استفاده میشوند ترکیبی از لیپوزومها با ویروسهای غیرفعال HIV یا آنفولانزا میباشند. ویروزومها نسبت به استفاده تنها از روش ویروسی یا لیپوزوم کارآمدتر هستند.
از روشهای هیبریدی دیگر میتوان ترکیب وکتورهای ویروسی با لیپیدهای کاتیونی یا ویروسهای هیبریداسیون را نام برد.