عمدهترین دلیل بیماری پارکینوسون از بین رفتن نورنهای دوپامینرژیک در جسم سیاه میانمغز (substantia nigra) است. از بین رفتن این نورونها تعادل بین مسیرهای مهاری و تحریکی مغز را تغییر میدهد، و درمقابل این مسیرها کنترل حرکت را تحت تاثیر قرار میدهند. دارو درمانی، به خصوص درمان جایگزینی دوپامین، در اواخر سال ۱۹۶۰ طراحی شده است و از آن زمان تا کنون به عنوان درمان اصلی تجویز میشود. اخیراً روشهای جراحی نیز (مانند پالیدوتومی یا تحریک عمیق مغز) برای بهبود عملکرد حرکتی طراحی شده است. در این روش فعالیت بی از حد سلولهای مغزی که در نتیجهی کاهش آزادسازی دوپامین رخ میدهد، به حالت نرمال خود بازگردانده میشود. به دلیل اینکه از طریق ژندرمانی میتوان نورونهای دوپامینرژیک را حفاظت و یا حتی بازگردانی کرد، از نظر تئوری مزایای بسیاری نسبت به درمانهای مرسوم پیشین دارد.
روش ژندرمانی مزایایی دارد (برای مثال به طور اختصاصی به محلی القا میشود که نیازمند درمان است؛ بنابراین احتمال عوارض جانبی کمتری دارد) که در بیماریهای پیشرونده مانند پارکینسون میتواند بسیار مفید باشد. تعدادی از پروتئینها برای ژندرمانی پارکینسون استفاده شدهاند. انتخاب پروتئین هدف، بسته به استراتژی درمانی متفاوت است. برای مثال یکی از استراتژيها افزایش انتقال دوپامین به نواحی مربوط به پارکینسون در مغز است. استراتژیهای دیگر فاکتور رشد را برای نواحی از مغز تامین میکنند به امید اینکه به تجدید سلولهای عصبی آسیب دیده کمک کرده و روند پیشرفت بیماری پارکینسون را کند یا در بهترین حالت موجب ترمیم کامل شود.
پس از انتخاب وکتور مناسب، درمان باید به نواحی مربوطه در مغز تجویز شود. مطالعاتی که تا کنون انجام شدهاند همه روی ناحیه خاصی از بازال گانگلیا اجرا شدند. بازال گانگلیا تعدادی از نواحی مرتبط عمیق مغزی هستند که در کنترل حرکت دخیل میباشند. یک مسیر اصلی جسم سیاه را به پوتامن (ناحیهای که در حالت نرمال دوپامین از آن آزاد میشود) و سپس به طور مستقیم یا از طریق هستههای سابتالاموس به گلوبوس پالیدوس متصل میکند.
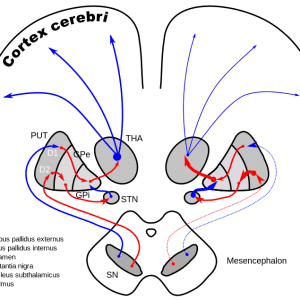
- به طور کلی تاکنون سه رویکرد اصلی برای ژندرمانی پارکینسون توسعه یافته است:
رویکرد اول افزایش تولید دوپامین در نواحی خاصی از مغز است. در این رویکرد از ژن آنزیم آمینواسید دکربوکسیلاز آروماتیک (AADC) استفاده میشود. این آنزیم لوادوپا را دوپامین تبدیل میکند. مطالعات نشان دادهاند که در بیماری پارکینسون AADC به تدریج از بین میرود. عقیده بر این است که از بین رفتن پیشروندهی این آنزیم موجب افزایش نیاز به دوزهای بیشتر از لوادوپا در طول زمان میشود. اساس این رویکرد این است که اگر در محلی که باید دوپامین آزاد شود مقدار بیشتری از AADC وجود داشته باشد، پاسخهای قابل اطمینانتر و حتی قویتری به لوادوپا رخ خواهد داد. علاوه بر آن بیمارانی که دیگر به درمان با لوادوپا پاسخ موثر نمیدهند، پس از ژندرمانی با AADC میتوانند دوباره از این درمان سود ببرند. به دلیل اینکه اثرگذاری این نوع ژندرمانی وابسته به ادامه درمان با لوادوپا است، نکته مهم در این رویکرد درمانی این است که بیمار ممکن است با تنظیم دوز روزانه مصرف لوادوپا، اثرگذاری درمان را تغییر دهد. یک مطالعه فاز یک که در آن تزریق AADC به پوتامن انجام میشد، در ۲ دوز متفاوت کامل شده است. در ۱۰ بیمار درمان شده عملکرد حرکتی و مقیاسهای بالینی بهبود داشتند و مطالعات تصویربرداری اختصاصی نیز شواهدی از یک ژندرمانی موفق را نشان میداد.
یک واریاسون دیگر از این استراتژی استفاده از ۳ ژن تولیدکنندهی آنزیمهای AADC، تیروزین هیدروکسیلاز (TH) و GTP-سیکلوهیدرولاز (GCH-1) است. این ۳ آنزیم باهم میتوانند بدون نیاز به لوادوپا خارجی، دوپامین بسازند. مزیت این نوع ژندرمانی عدم نیاز به ادمه درمان با لوادوپا است. با وجود اینکه این ژندرمانی به نظر جذاب میآید اما نگرانیهایی درمورد آن وجود دارد؛ زیرا مزایی آن وابسته به تولید دقیقاً مقدار مشخصی از دوپامین است. برای مثال، دوز بسیار بالای ژندرمانی میتواند موجب مشکلاتی ناشی از تولید بیش از حد دوپامین شود.
رویکرد دوم تنظیم یا تعدیل مسیرهای تحریکی و مهاری مغز است. اساس این استراتژی این است که سلولهای عصبی هستههای سابتالاموس بیش از حد فعال شدهاند و آزاد شدن یک نوروترنسمیتر مهاری در این ناحیه میتواند این سلولها را به حالت نرمال بازگرداند. ژن آنزیم گلوتامیک اسید دکربوکسیلاز (GAD) که نوروترنسمیتر مهاری GABA را تولید میکند، در یک مطالعه فاز ۲ روی ۴۵ داوطلب بررسی شده است. نتایج حاکی از ایمن بودن واثرگذاری این رویکرد بود.
رویکرد سوم استفاده از نوعی پروتئینهای مغزی به نام فاکتور رشد (به دلیل نقش آنها در تکامل مغز) است، که میتواند مانع از پیشرفت بیماری پارکینسون و یا حتی با تحریک ذشد دوبارع سلولهای عصبی آسیبدیده پروسه بیماری را معکوس کند. تعداد متعددی از فاکتورهای رشد در طول زمان شناسایی شدهاند؛ از جمله فاکتور نوروتروپیک مشتق از سلولهای گلیال (GDNF) و نئورترین که مشابه GDNF بوده و مانند آن دارای توانایی افزایش میزان زنده ماندن نورونهای دوپامینرژیک است. هر دو مطالعه فاز ۱ و ۲ برای ژندرمانی با نئورترین با هدفگذاری پوتامن، انجام شده است. در مطالعه فاز ۲، ۳۸ بیمار داوطلب تحت درمان قرار گرفتند. متاسفانه در طول ۱۲ ماه تفاوت چشمگیری در نتایج اصلی وجود نداشت. با این حال زیرگروهی از یماران که به طول ۱۸ ماه تحت نظر بودند به مقدار جزئی پس از دریافت ژندرمانی عملکرد بهتری داشتند. بنابراین برای تعیین دقیق مزایای این نوع ژندرمانی مطالعه طولانی مدتی نیاز است، بر این اساس مطالعه فاز ۲ دیگری نیز درحال انجام است که در آن ژندرمانی نئورترین در جسم سیاه نیز هدفگذاری شده است.
استراتژيهای دیگری نیز برای ژندرمانی پارکینسون طراحی شده است. در یکی از چنین مطالعاتی از اریتروپوئیتین انسانی استفاده میشود، نتایج این مطالعه روی حیوانات آزمایشگاهی نشان داده است اریتروپوئیتین در برابر توکسینهایی که اغلب موجب آسیب به سلولهای دوپامینرژیک میشود، ایجاد یک سد محافظتی میکند. دیگر روشهای درمانی بر روی دلایل ژنتیکی بیماری پارکینسون تمرکز دارند.
